GENÇLERDE
İSKEMİK İNME
Yazanlar: Nilüfer Yeşilot,
Rezzan Tuncay
Son Güncelleştirme
Tarihi: 01.11.2019
İskemik inmelerin yaklaşık ¼ü,
yüksek gelirli ülkelerde çalışma yaşında olan erişkinlerde görülmektedir
ve tüm dünyada bu yaş grubundaki insidens 1980lerden günümüze artış göstermektedir.
Genç inme için, biyolojik temeli olmasa da, özellikle risk faktörleri ve etyoloji
açısından klinik özelliklere dayanan yaş sınırı genellikle 50 olarak kabul
edilir. Farklı çalışmalarda 45 veya daha az sıklıkla 55 üst sınırı da kullanılmaktadır.
Ayrıca son yılarda bilinen vasküler risk faktörlerinin, özellikle genç erkeklerde,
önceden bildirilenlere göre daha sık olduğu gözlenmektedir. Fakat bu sıklık
artışı klasik inme mekanizmalarında artış olarak kendini göstermemektedir.
Şöyle ki, nedeni belirlenemeyen inmeler gençlerde çok sıktır ve inme 30 yaşından
gençlerde %50ye yaklaşan oranda kriptojeniktir.
İNSİDENS
Dünyada 15-45 yaş için inme
insidensi 100.000de 6-26 olarak bildirilmekle birlikte, Hindistandan 18-49
yaş arasında 100.000de 46 ve Çinden 18-45 yaş için 100.000de 98 olarak
daha yüksek insidensler de bildirilmiştir. Finlandiyadan bildirilen bir
çalışmaya göre insidens 35 yaşın altında 100.000de 1,2-4,5 iken 45-49 yaş
aralığında 100.000de 32,9a ulaşmaktadır. Genç
inme kadınlarda 35 yaşın altında daha sık görülürken, erkeklerde 35-50 yaş
arasında daha sık görülmektedir. Üreme çağındaki genç kadınlarda cinsiyete
özgü risk faktörlerinin, orta yaşlı erkeklerde ise vasküler risk faktörlerinin
yoğunlaşmasının cinsiyete özgü insidens farkına yol açtığı düşünülmektedir.
RİSK FAKTÖRLERİ
İyi belgelenmiş risk faktörlerinden
genç inmelilerde yüksek oranlarda (%25-59) bildirilen ve inmeyle bağlantısı
en fazla olan (Odds oranı [OR] 1,6-7,7) sigara kullanımıdır. Gençlerde sigara
kullanımı ve inme arasında kümülatif bir etki bulunmuştur
ve etyolojik alt tipler arasında heterojenite göstermemektedir. Beş binden
fazla genç (18-55yaş) inme hastasının sistematik bir şekilde kaydedildiği
ve Fabry hastalığının sıklığının araştırıldığı bir çalışma olan SIFAP1de
fiziksel inaktivite sigara kullanımından (%56) sonra ikinci en sık görülen
risk faktörü olarak %48 hastada belirlenmiştir. Fiziksel inaktivite ve inme
arasındaki ilişki tek bir Tayland çalışmasında araştırılmış ve inme riskini
8 kat arttırdığı bulunmuştur.
Hipertansiyon, farklı tanımları
olan ve üst yaş sınırı 45-55 yaş arasında değişen farklı serilerde, %12-75
arasında değişen geniş bir aralıkta risk faktörü olarak bildirilmiştir, Asyadan
bildirilen serilerde bu açıdan daha yüksek oranlar görülmektedir. İnme ile
bağlantısı da (OR 1,6-8,9) olarak bildirilmiştir. INTERSTROKE çalışmasında
hipertansiyon için 3,14 olan OR, 45 yaşın altındakiler için 8,53e çıkmaktadır,
ancak bu OR hemorajik ve iskemik inmeler için beraber hesaplanmıştır. Dislipidemi
de benzer şekilde, farklı tanımlamalar nedeniyle, genç inme serilerinde %
8,1-59,5 olacak şekilde geniş bir aralıkta risk faktörü olarak bildirilmiştir.
HDL düzeyi düşüklüğü ile genç inme arasında ilişki gösterilmişken, LDL kolesterol,
total kolesterol ve trigliserit düzeyleriyle net bir ilişki gösterilmemiştir.
Bir meta-analizde lipoprotein(a) ve iskemik inme arasındaki ilişkinin 55
yaş altındakilerde daha güçlü olduğu bulunmuştur.
Diyabet sıklığı genç inmelilerde
%1-18 olarak kaydedilmiştir. Birkaç çalışmada diyabetin genç inme için ORsi
3,3-11,6 olarak bildirilmiştir ve INTERSTROKE çalışmasında inme için bildirilen
1,6 oranından daha yüksektir. Makrovasküler tip 2 diyabet komplikasyonlarının
izlendiği bir araştırmada 45 yaşından önce diyabet tanısı alan hastalarda,
45 yaşından sonra tanı alan hastalara göre inme riskinin 10 kat arttığı görülmüştür.
Genç yaşta ortaya çıkan vasküler komorbiditelerin, hastalığın daha erken
ve agresif formları olup gençliğin görece koruyucu etkisinin kaybına yol
açtıkları düşünülmektedir. SIFAP 1 çalışmasında hastaların %22sinde, vücut
kitle indeksi 30un üzerinde olacak şekilde tanımlanmış obezite saptanmıştır,
bel ölçümüne göre (erkeklerde ≥ 94 cm, kadınlarda ≥ 80 cm) tanımlanırsa obezite
%69 hastada izlenmektedir. Genç inme olgu serilerinde obezite genellikle
bildirilmemekle birlikte, mevcut kısıtlı sayıdaki çalışmada bildirilenlerde
sıklığı % 5-28dir.
Koroner arter hastalığı (%1-16)
ve atriyal fibrilasyon (%1-8,9) gençlerde daha az rastlanan risk faktörleridir.
Uzun süreli veya yakın zamanda yoğun alkol tüketiminin gençlerde inme ile
bağlantısının daha kuvvetli olabileceği bildirilmiştir. Genç inme olgu serilerinde
%5-33 sıklığında alkol kullanım oranları saptanmıştır.
İyi belgelenmiş vasküler risk
faktörleri dışında genç inmeye özgü olabileceği düşünülen risk faktörleri
Tablo 1de gösterilmiştir. Genç yaşa özgü risk faktörleri yalnızca
genç yaşta görülen, her yaşta görülen ancak inmeyle ilişkisi genç yaşta daha
güçlü olan veya genç yaşta daha sık görülen zararlı davranışla ilişkili risk
faktörleri olabilir. Tablo 1de sunulan risk faktörleri ile inme arasındaki
ilişki, iyi belgelenmiş risk faktörlerinin inmeyle ilişkisinden daha zayıftır,
çalışmalar arasında sonuçlar tutarlı değildir. Bu risk faktörlerinin çoğu
toplumda sık olduğu için birden fazla faktörün bir araya gelmesi, sonuç olay
olan inmeye neden olmaktadır. Bu gibi durumlara örnek olarak antifosfolipid
antikorlarının, infeksiyon veya östrojen gibi bir tetikleyici nedenle birlikte
inmeye neden olması gösterilebilir. Auralı migren tek başına düşük risk yaratırken,
sigara kullanımıyla birlikte östrojen kullanımının riski arttırdığı bilinmektedir.
Tablo 1. Genç erişkinlere özgü olabilecek iskemik inme risk faktörleri
|
Risk faktörü |
Hastalarda
yaklaşık prevalansc |
İlişki kuvvetia |
Yorum |
|
Gebelik/puerperium |
Kadınlarda %7,5 |
Puerperiumda RR 8,7 |
Gebelik için anlamlı ilişki yok, çelişkili sonuçlar |
|
Kombine oral kontraseptifler |
Kadınlarda %10-40 |
≥50µg östrojen içerenlerle kullanmama karşılaştırıldığında OR 2,1 |
Çelişkili sonuçlar; herhangi bir doz östrojen için veya 50µgın altındaki dozlar için anlamlı ilişki yok |
|
Migren |
%20-27 |
OR 2,3 |
Kadınlar, auralı migren, sigara kullananlar, oral kontraseptif kullananlar, aktif migren ve kriptojenik inme için daha güçlü ilişki |
|
Patent foramen ovale |
%24-50 |
<55 yaş için OR 5,1 |
Topluma dayalı çalışmalarda ilişki bulunmadı |
|
Antifosfolipid
antikorlarıb |
%18-46 |
Lupus antikoagülanı: OR 2,2-43,1 (kadınlar) Antikardiyolipin antikorları: OR anlamlı değil-1,78, isotipe göre Anti-β2-glikoprotein-I antikorları (sınır kontrollerin 90.persantili) OR 2,3 (kadın) |
Çelişkili sonuçlar; çoğunlukla kadınlarda çalışılmış; sigara kullananlar ve oral kontraseptif kullananlarda daha güçlü ilişki |
|
Genetik trombofili |
Protrombin G20210A mutasyonu: %2-6 Faktör V Leiden G1691A mutasyonu:%3,0-7,5 Protein C eksikliği: %4-21 Protein S eksikliği: %6-23 Antitrombin III eksikliği:0.3-8% |
Protrombin G20210A mutasyonu için ≤ 55 yaş için OR 1,5; ≤ 42 yaş için daha güçlü ilişki Faktör V Leiden G1691A mutasyonu: hasta seçimine bağlı olarak OR 1,4-2,7 Metilentetrahidrofolat redüktaz C677T: OR 1,2 Protein C, protein S ve antitrombin III eksikliği için OR bildirilmemiş |
Sıklıkla seçilmiş gruplarda çalışılmış; araştırmalar arasında heterojen ve çelişkili sonuçlar |
|
Aktive intrinsik koagülasyon proteinleri |
≈ %50 kadınlarda |
Araştırılan tüm koagülasyon proteinleri için OR ≈ 2,5 |
Genç kadınlarda (ortalama 39 yaş) araştırılmış: oral kontraseptif kullanımıyla risk artışı |
|
Periodontit |
Bilinmiyor |
>6 mm yapışma kaybı için OR 6,1 |
Yalnızca <60 yaş için anlamlı ilişki var; kriptojenik inme için daha güçlü ilişki |
|
Uzun çalışma saatleri |
≈% 9 |
≥55 saat/hafta çalışma için RR 1,33 |
RR tüm inmeler için doz-yanıt ilişkisi bulunmuş |
|
Vardiyalı çalışma |
Bilinmiyor |
RR 1,05 |
|
|
Psikolojik stres |
%29 |
OR 3,5 |
Araştırma grubunun ortalama yaşı 56 |
|
Hava kirliliği |
|
<10µm partiküller için OR 1,11 |
Olgu-geçiş analizi; <55yaş kişilerde anlamlı ilişki bulunmuş, ≥55 yaş olanlarda bulunmamış |
|
Yoğun alkol |
%12-59 |
Uzun süreli ≥60g/gün alkol kullanımı için OR 15,3 |
İlişki daha gençlerde daha güçlü olabilir |
|
Madde kötüye kullanımı |
%9-20 |
Kannabis için OR 2,3 Kokain için OR 2,0 |
Sigara kullanımı için düzeltme yapılırsa kannabis için bağımsız ilişki yok; amfetamin kullanımı için anlamlı ilişki yok |
OR: odds oranı, RR: rölatif risk.
aMeta-analiz düzeyi veri varsa risk, çalışmaların toplamından elde edilen toplam yaklaşık risk olarak verilmiştir
bAntifosfolipid sendromu veya sistemik lupus eritematozus yoksa
cPrevalansta değişkenlik başlıca kohortların seçimine bağlıdır ve genellikle kriptojenik olgularda daha yüksektir
ETYOLOJİ
On beş Avrupa şehrinin hastane
kayıtlarından verilerin toplandığı bir çalışmada, genç inmelerde etyolojik
neden olarak % 22 oranında nadir nedenler, %17,3 oranında kardiyoembolik
nedenler (%8,6 yüksek riskli, %8,6 düşük riskli), %12 oranında küçük damar
hastalığı, %9 oranında büyük damar hastalığı saptanmıştır ve hastaların %40ında
neden belirlenememiştir. Bilinen etyolojilerden tek başına en sık görülen
neden servikal arter diseksiyonu olarak bulunmuştur. Büyük damar aterosklerozu
ve küçük damar hastalığı erkeklerde daha sık görülmüştür.
Patent Foramen Ovale
Kardiyoembolik inmelerde hastaların
%35inde etyolojik neden olarak patent foramen ovale (PFO) belirlenmiştir.
Olgu-kontrol çalışmalarında PFO ve inme arasında ilişki gösterilmişse de topluma
dayalı çalışmalarda bu ilişki saptanmamıştır. Patent foramen ovalenin derin
ven trombozundan paradoksal emboli, atriyal aritmi eğilimi, PFO içinde trombüs
oluşumu gibi mekanizmalarla inmeye yol açtığı düşünülmektedir. Patent foramen
ovale-ilişkili inme gelişmesi için PFOnun uzunluğu ve boyutu, atriyal septal
anevrizma varlığı, istirahatte sağdan sola şant gibi PFOnun transözefagial
ekokardiyografik özelikleri veya venöz tromboz eğilimi yaratan (örneğin,
yatak istirahatı, uzun süreli yolculuk, immobilizasyon, travma, alt ekstremite alçılanması) presipitan faktörler
gibi konkomitan faktörlerin bulunması beklenir. Pek çok çalışmada PFOnun
inme nedeni veya rastlantısal bir bulgu olarak belirlenmesi için kriter kullanılmamıştır.
Yakın zamanda nedenselliği belirlemeye yardımcı olabileceği düşünülen Parodoks
Emboli Riski (RoPE) skoru geliştirilmiştir. Bu skor 0-10 arasında değerlendirilir,
yaş, (0-5 puan: yaş 18-29 ise 5, 30-39 ise 4, 40-49 ise 3, 50-59 ise 2, 60-69
ise 1, ≥70 yaş ise 0 puan), vasküler risk faktörlerinin olmaması (hipertansiyon,
diyabet, GİA veya inme öyküsü, sigara kullanımı özeliklerinin her birinin
olmaması için birer puan) ve kortikal infarkt varlığı (1 puan) özellikleri
ile hesaplanır. Fakat PFOnun transözefagial ekokardiyografik özellikleri
ile PFOnun patojenik olduğunu düşündüren RoPE skorları arasında ilişki bulunamamıştır.
Yakın zamanda yapılan bir meta-analizde, PFO transkateter kapatma yöntemi
ile en iyi medikal tedaviyi karşılaştırılmasında, PFO kapatma yöntemi ile
rekürran inme ve/veya GİA riskinde daha anlamlı bir azalma (HR:0,59) bulunmuştur.
Diğer açıklayıcı nedenler dışlandıktan sonra kriptojenik genç inmeli (≤ 55
yaş) hastaların, RoPE skoru en az 6 veya yüksek riskli olan (en azından orta
derecede sağdan sola şant veya atriyal septal anevrizma olan) PFOlu hastalarda
PFO kapatılması ve medikal tedavinin birlikte uygulanması önerilmektedir.
Servikal Arter Diseksiyonu
Servikal arter diseksiyonu genç
inme kohortlarında %10-25 sıklığında bildirilen, diğer bilinen etyolojik
nedenlerin en sık görülenidir. Mekanizması iyi bilinmemekle birlikte, patolojik
olarak subintimal bir yırtık veya vasa vasorumun bozulmasıyla biriken mural
kanın intima ve medya katmanları arasında diseksiyon ile karakteristik olarak
luminal stenoza, daha az sıklıkla da medya ve adventisya arasında disekan
anevrizma oluşumuna neden olduğu düşünülmektedir. Hastalar ağrı ve lokal semptomlarla (örneğin, Horner sendromu, alt kranial
sinir parezisi) başvurabilirler, ancak %70ten fazla hastada inme veya GİA
gelişir. Diseksiyon hastaların %60ında spontan gelişirken bir çoğunda minör
veya majör travma, boyun manipülasyonu gibi tetikleyiciler
bulunur. Diseksiyonlu hastalarda diğer inmeli hastalardan daha fazla oranda
migren, özellikle de aurasız migren izlenir. Hipertansiyon ve inme öncesi
infeksiyon da diseksiyonlu hastalarda daha sıkken hiperkolesterolemi daha
nadirdir. Hastalarda düşük vücut kitle indeksi de sıktır.
Diseksiyonlu hastaların %2sinde
otozomal dominant şekilde kalıtılan COL3A1 kollajen gen mutasyonlarına
bağlı vasküler Ehlers-Danlos sendromu saptanmıştır.
Genetik çalışmalarda aurasız migren riskiyle de ilişkili olduğu bilinen rs9349379
[G] alelinin (PHACTR1) diseksiyon riski ile ilişkili olduğu bulunmuştur.
Ayrıca diseksiyon hastalarının %16,4ünde kas organ gelişimi veya hücre farklılaşması
ile ilgili genleri etkileyen nadir gen kopya sayısı varyantları saptanmıştır.
Sonuçta genetik, çevresel ve bireysel faktörlerin kompleks etkileşimi ile
diseksiyonun ortaya çıktığı düşünülmektedir. Radyolojik özellikleri arasında
uzun-incelen stenoz,
intimal flap, intramural hematom, çift lümen, bifurkasyonun>2cm üstünde
oklüzyon (mum alevi görünümü), psödoanevrizma veya rekanalizasyon sonrası
uzun ince stenoz vardır (Şekil 1). Servikal yağ baskılamalı T1 manyetik
rezonans (MR) sekanslarında intramural hematom
hiperintens olarak görülür (Şekil 2). Diseksiyonda intravenöz ve intraarteryel
trombektomi, diseksiyon olmayanlarla aynı güvenilirlikte bulunmuş, ancak
tedavi edilen ve edilmeyenler arasında klinik sonlanım açısından fark bulunmamıştır.
Antiagregan tedavi ve heparinle başlanıp varfarinle 3 ay süre ile devam edilen
antikoagülan tedavinin karşılaştırıldığı bir çalışmada tekrarlayan inme ve
ölümü önleme açısından fark bulunmamıştır. Akut diseksiyondan sonra antitrombotik
tedaviye yanıt vermeyen hastalarda anjiyoplasti ve stent uygulaması düşünülebilir.
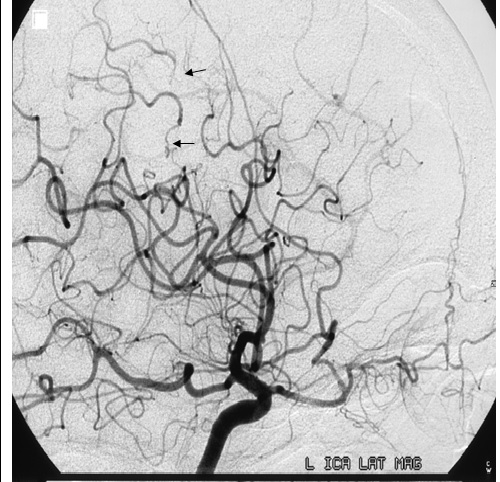
Şekil 1. Karotis diseksiyonunda konvansiyonel anjiografi. Karotis anjiografisinde
(lateral görünüm) sağ ICAnın incelerek tıkandığı görülüyor (ok başı).
Şekil
2.
Karotis
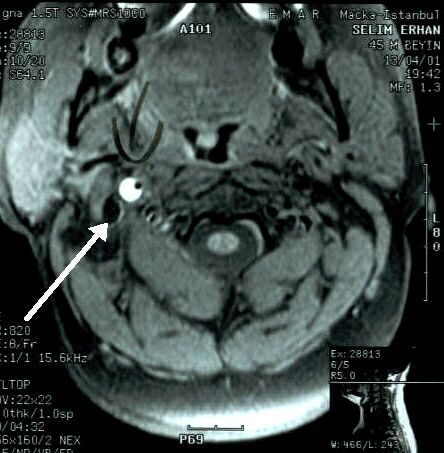
diseksiyonunda MR incelemesi. Servikal bölge yağ baskılamalı T1 ağırlıklı
MR incelemesinde aksiyal planda alınan kesitlerde sağ ICAyı çevreleyen beyaz
renkte intramural trombüs görülüyor (ok)
Sistemik Lupus Eritematozus
ve Antifosfolipid Antikor Sendromu (AAS)
Sistemik lupus
eritematozus (SLE) otoimmün kökenli sistemik inflamatuar bir hastalıktır
ve çoğunluğu ilk yılda olmak üzere %3-20 sıklığında inme gelişebilir. SLEde
iskemik ve hemorajik inme gelişiminde etkili mekanizmalar arasında hastalığa
özgü hiperkoagülabilite durumu (antifosfolipid antikorların bulunması), Libman-Sacks
endokarditinden embolizm, SLE hastalık aktivitesi, serebral vaskülit, reversibl
serebral vazokonstriksiyon sendromu, hızlanmış
ateroskleroz, hiperhomosisteinemi ve bilinen inme risk faktörleri (örneğin,
hipertansiyon, diyabet, sigara) sayılabilir. SLE ile ilişkili inmenin akut
tedavisi diğer inmelerden farklı değildir. SLEde majör inme nedenleri kardiyak
embolizm ve hiperkoagülabilite durumu olduğundan ikincil korumada varfarinle
antikoagülasyon (INR düzeyi 3 civarında tutulacak şekilde) önerilir. Sistemik
vaskülit aktivasyonu olan hastalarda veya antikoagülan, antiagregan tedaviye
rağmen tekrarlama olanlarda steroid ve sistemik immünomodülatuvar tedaviler
verilmelidir.
Antifosfolipid
antikorlar belirli fosfolipidlere karşı oluşan poliklonal antikorlardır.
En sık görülenleri lupus antikoagülanı (LA), antikardiyolipin antikorları
ve anti-beta-2-glikoprotein 1 (anti-b2GP-1) antikorlarıdır. Antifosfolipid
antikorları bazen SLE ile birlikte olabilir. Primer AASde antikardiyolipin
ve anti-b2GP-1antikorların en az 12 hafta ara ile bakıldığında
orta-yüksek pozitifliği ve trombotik olay veya tekrarlayan fetal kayıp kanıtı
olmalıdır.
Sağlıklı
kişilerde antifosfolipid antikorlarının prevalansı % 0-2 arasındadır. Bunun
yanısıra SLE, diğer kollajen vasküler hastalıklar, maligniteler, lenfoma,
paraproteinemiler, HIV ve diğer infeksiyonlar, bazı ilaçların kullanılması
sırasında da (fenotiazin, fenitoin, valproat, prokainamid, kinidin) antikor
yüksekliği bulunabilir. Ancak iskemik inmeli genç hastalar arasında prevalans
yüksektir. Antiphospholipid Antibodies in Stroke Study Group (APASS), ilk
iskemik inmeli olgularda antikardiyolipin antikorlarının yüksek olmasının
bağımsız bir risk faktörü olduğunu göstermiştir. Antifosfolipidler IgG, IgM,
IgA gibi immünoglobulinlerdir. Çeşitli çalışmalarda retinal veya serebral
iskemili hastalarda IgGnin IgMye göre anlamlı derecede yüksek bulunduğu
gösterilmiştir.
Primer AASde
tekrarlayan düşükler, ölü doğumlar, değişik çaptaki damarlarda arteryel ve
venöz trombozlar, livedo retikülaris, kalp kapağı vejetasyonları, migrene
benzer baş ağrıları, trombositopeni, yalancı pozitif sifiliz testi başlıca
bulgulardır. Antifosfolipid antikor sendromlu hastalarda arteryel trombotik
olaylar en sık inme olarak ortaya çıkar. Ancak kalp kapaklarında oluşan vejetasyonlara
bağlı olarak embolik inmeler de oluşabilir. En sık mitral kapak tutulur.
AAS düşünülen bir hastada, antikorlar normal ise, birkaç hafta sonra inceleme
tekrarlanmalıdır. Akut atak sırasında antikor titresi düşük bulunabilir.
Primer AASli hastaları trombozdan korumak için sıklıkla antikoagülan tedavi
uygulanmaktadır. INR değeri yaklaşık 3,0 civarında tutulmalıdır. Antifosfolipid
antikor sendromlu iskemik inmeli hastaları tekrarlayan
inmeden korumak için antiagregan veya antikoagülan tedavinin üstünlüğü konusunda
kesin bilgi yoktur.
Sneddon Sendromu
Livedo retikularis veya livedo
rasemoza olarak tanımlanan deride morumsu ağ tarzında deri değişikliği ve
iskemik serebrovasküler lezyonların, başka sistemik inflamatuar hastalık
veya bağ dokusu hastalığı olmadan bir arada görülmesi Sneddon sendromu olarak tanımlanır. Deri lezyonları gövdenin
alt yarımı, kalçalar ve uyluk proksimalindedir, inmeden ortalama 10 yıl önce
başlar ancak inmeyle beraber, çok nadiren de inmeden yılar sonra ortaya çıkabilir.
Bazı hastalarda Raynaud fenomeni eşlik edebilir, bazen lezyonlar gövde üstüne,
ekstremite distallerine de ilerleyebilir. Başağrısı, baş dönmesi kognitif
bozukluklar, nöbetler ve kural olarak tekrarlayan GİA ve inmeler görülür.
Değişen oranlarda antifosfolipid antikor pozitifliği ile birlikteliği bildirilmiştir.
Yüzde altmışa varan oranda SLEdeki Libman-Sacks endokarditine benzer kardiyak
valvulopati saptanmıştır. Deri biyopsilerinde derin dermal veya subkutan
dokuda orta boy arteriollerde endotelit, inflamatuvar hücre infiltrasyonu,
arterioler lümen oklüzyonu saptanır. Vaskülitik olmayan bir küçük ve orta
boy damar arteriopatisinin beyin ve deri semptomlarına yol açtığı düşünülmektedir.
İnme sırasında deri lezyonlarının alevlenmesi deri ve MSS semptomlarının
dolaşan immünglobulinler veya vasküler yatağın bazı bölgelerine spesifik sinyal yolakları gibi ortak bir nedene bağlı
olabileceğini akla getirir. Tedavide varfarinle antikoagülasyonun inme tekrarını
önlemede tek başına aspirinden daha etkili olduğu düşünülmektedir, immünosupresanlar
ise etkisizdir.
Primer Merkezi Sinir Sistemi
Vasküliti (Primary Angiitis of the Central Nervous System-PACNS)
Merkezi sinir sisteminin primer
(izole) vasküliti (anjiiti), insidensi 1/200.000den az olduğu düşünülen,
küçük leptomeningeal ve parenkimal damarlarla sınırlı idyopatik bir vaskülittir.
Non-spesifik T-hücre aracılı inflamasyon, küçük (çap<500µ) ve orta boy
damarlarda segmenter lenfosit, makrofaj ve histiyosit infiltrasyonu tüm damar
cidarını içerebilir fakat medya tabakası korunur, fibrinoid nekroz ve dev
hücreli granülomlar görülebilir. Erkeklerde kadınlardan yaklaşık 2 kat daha
sıktır ve en sık 40-50 yaşlarında görülür. Klinik olarak kalitesi ve şiddeti
değişken olabilen başağrısı ile bilinç değişiklikleri, bellek bozuklukları,
iskemik inmeler, subaraknoid ve intraparenkimal kanamalarla kendini gösteren
fokal nörolojik defisitlere neden olur. Nöbetler, kranial nöropatiler ve
spinal tutulum daha az sıklıkta eşlik edebilir. Ateş %15 sıklığında olabilse
de diğer sistemik belirtiler de varsa multi-organ vaskülitine yönlenilmelidir.
Olguların %30unda sedimentasyon hızı yüksek bulunabilir, vaskülit belirteçleri
negatiftir, biyopsi ile kanıtlanmış olguların %90ında BOSta orta düzeyde
lenfositik pleositoz, protein yüksekliği ve normal glukoz düzeyi saptanır.
Fundoskopide retinal perivasküler inflamatuar lezyonlar görülebilir, optik
anjiyografi yararlı olabilir. Beyin görüntülemesinde Bilgisayarlı tomografi (BT) ve MRGlerde iskemik infarktlar, intraserebral
hematom, subaraknoid kanama, non-spesifik T2 lezyonları, lökoensefalopati,
FLAIR sekansında distal intrakranial stenoz düşündürten hiperintens damar
bulgusu, lineer veya noktasal leptomeningeal kontrast tutulumu görülebilir.
Yüksek çözünürlüklü MR ile damar duvarının görüntülenmesi tanıda yardımcı
olabilir. Karakteristik anjiyografi bulgusu sosis benzeri görünüme yol açan
multi-fokal stenozlar, ektazi ve arteryel oklüzyonlardır (Şekil 3).
Bu görünüm reversibl serebral vazokonstriksiyon sendromunda
(RCVS) da görülebilir, ancak RCVS lezyonlarının haftalar-2 ay içinde kaybolması,
klinik olarak gök gürültüsü başağrısı, vazokonstriksiyonu tetikleyen bir
faktörün olması ve nimodipin veya diğer kalsiyum kanal blokerleri ile hızlı
şekilde düzelmesiyle PACNSden ayrılır. Beyin biyopsisi leptomeninks ve kortikal
damar içeren korteksten 1 cmlik kama şeklinde alınmalıdır. Fokal lezyonu
olmayanlarda biyopsi dominant olmayan temporal lob ucundan veya prefrontal
alandan alınır. En az 6 ay süreyle başağrısı ve fokal nörolojik defisitlerin,
serebral anjiyografide segmental arteryel stenoz serebral ve/veya leptomeningeal
biyopside inflamatuar lezyonların gösterilmesi ve diğer enfeksiyöz, inflamatuar
nedenlerin dışlanmasıyla tanı konur. Son yıllarda yalnızca küçük damarları
tutan ve daha az iskemik inme, daha çok leptomeningal kontrast tutulumu, kognitif bozukluk, nöbet ve nüks
eğilimi olan bir grup hasta tanımlanmıştır. Tedavide steroid, hızlı ve kötü
seyirli olgularda remisyon sağlandıktan 6-12 ay sonrasına kadar steroidle
birlikte siklofosfamid kullanımı önerilmektedir. BOS bulgularının gerilemesi,
klinik düzelme ile paralellik gösterebilir, non-invazif damar görüntülemesi
takipte kullanılabilir.
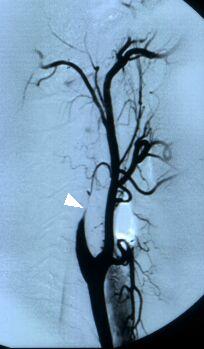
Şekil
3.
Santral
sulkus, presantral ve postsantral sulkus düzeylerinde MCA distal arteryel
oluşumlarda düzensizlik, oklüzyon ve daralmalar, (ince oklar).
MCA:a.cerebri media
Moyamoya Hastalığı
Moyamoya hastalığı (MMH) anterior
sirkülasyonun (distal karotis interna, proksimal
anterior serebral arter ve orta serebral arter) etyolojisi bilinmeyen progresif
oklüzif arteriopatisidir ve beyin tabanında anjiyografide duman görünümüne
yol açan anormal kollateral damarların oluşumu eşlik eder (Şekil 4).
Kuzeydoğu Asyalılarda insidensi 3/100.000dir (erkek kadın oranı 1:1,6-1,8),
Batı ülkelerine göre 10 kat daha sık görülür ve 14 yaş altı çocuklar ve 25-49
yaş gençlerde sıktır. Altta yatan orak hücreli anemi, nörofibromatozis, Down
Sendromu, kranial radyoterapi veya SLE, AAS gibi otoimmün hastalıklara bağlı
geliştiğinde ise Moyamoya Sendromu olarak adlandırılır, gençlerde ve unilateral
tutulumda akla gelmelidir. İki araştırmacı grubu 2011 yılında Japon Moyamoya
hastalarında ilk kez hastalık geni olarak 17.kromozomda (17q25.3) yerleşmiş
ring finger protein 213ü (RNF213) tanımlamışlardır. Sporadik ve
ailevi MMH formlarının her ikisinde de genom boyu ilişkilendirme çalışmalarıyla p.R4810Kda aminoasit değişikliğine yol açan tek
bir baz yer değişiminin (rs112735431 veya ss179362673, c.14429G>Aya karşılık
gelen) MMH ile güçlü bir bağlantı gösterdiği bulunmuştur. Bu varyant, Japon
hastalarda founder haplotipinde bulunmuş ve MMH için OR >190 olarak
saptanmıştır. Hem Japon, hem de Koreli hastalarda, daha az derecede de Çinli
hastalarda MMH ile güçlü ilişkisi olduğu (maksimum OR=339) gösterilmiştir.
Ancak bu ilişki beyazlarda bulunmamaktadır. RNF213 geninin MMHnin vasküler lezyonlarına nasıl yol açtığı henüz bilinmemektedir.
Beyazlarda şimdiye kadar MMH ile ilişkili bir lokus veya gen tanımlanmamıştır.
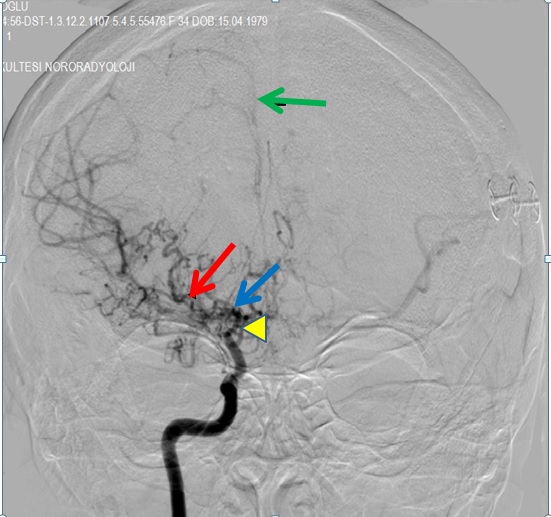
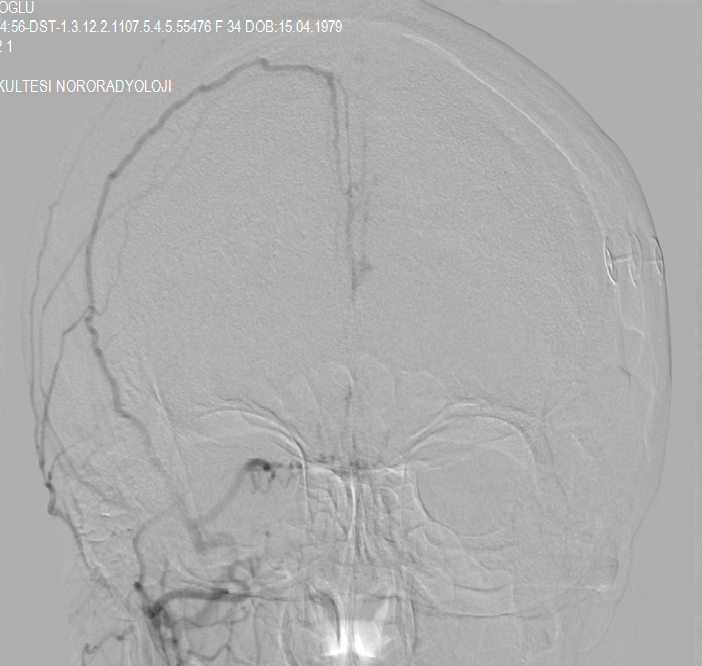
Şekil 4a ve Şekil
4b.
İlk resimde (Şekil
4a) sağ ICA supraklinoid parçası
ve A1 ince bir şekilde görülüyor (sarı ok), sağ M1 başlangıcı tıkalı görünümde
(mavi ok). ICA bifurkasyon bölgesinden gelişen genişçe bir damar ile birlikte
(sağ putamene doğru uzanım gösteren) çok sayıda patolojik neovaskülarizasyonla
birlikte sağ MCAnın anterograd dolduğu görülüyor (kırmızı ok). Sağ ACA iyi
seçilmemekte (yeşil ok). Patolojik kollateraller aracılığyla kontrast maddenin
sol MCA alanına geçtiği görülüyor. Kontrast madde enjeksiyonundan sonra supraorbital
bölgede gelişmiş bir neovaskülarizasyon var. Diğer resimde (Şekil
4b) etmoidal arter ve gelişmiş a.meningea
media aracılığıyla gelişen transdural anastomozlarlar intrakranyal (serebral)
sirkülasyon yüzeyel dolaşıma katkıda bulunuyor. ICA: a.karotis interna, ACA:
a.cerebri anterior, MCA:a.cerebri media
Klinik olarak sınır sulama alanlarında
tekrarlayıcı infarktlar, bazal ganglia ve talamusta sık olarak anormal kollateral
damarların yırtılması ile gelişen hemorajik inmeler görülür. Anormal kollateral
dolaşıma bağlı migrenöz tipte başağrıları eşlik edebilir. Tekrarlayan inmelere
bağlı progresif kognitif yıkım ve özürlülük gelişir. Tanıda MRG ve BT anjiyografi
ipuçları sağlasa da, anjiyografi ile karakteristik Moyamoya fenomeninin gösterilmesi gerekir. Gençlerde MMH nadiren
inmeye neden olduğundan radyolojik Moyamoya görünümü saptandığında diğer
ilişkili olabilecek nedenler de araştırılmalıdır. Akut inme ve hemorajinin
tedavisi diğer inmelerdeki gibidir, sekonder korunmada antiagregan tedavi
uygulanır, kanama riski nedeniyle antikoagülan tedaviden kaçınılır. Yeni kollateraller
yaratarak beyin dolaşımını iyileştirip tekrarlayan iskemik inmeleri önlemek
ve anormal kollaterallerden tekrarlayan kanamaları önlemek için doğrudan
arteryel anastomoz (örneğin, superfisyal temporal arter-orta serebral arter),
sinajiyozis (örneğin, ensefalodurarteriosinajiyozis, ensefalomiyosinajiyozis),
çoklu burrhole açılması gibi cerrahi tedaviler geliştirilmiştir. Japonyada
yapılan prospektif bir çalışmada iki yanlı direkt ekstrakranial-intrakranial
by-pass cerrahisinin tekrarlayan kanamaları azalttığı gösterilmiştir. Moyamoya
sendromunda altta yatan hastalığın tedavisi gerekir.
Takayasu Hastalığı
Takayasu hastalığı
(nabızsızlık hastalığı, idyopatik aortitis) aorta ve dalları ile seyrek olarak
pulmoner arterleri tutan, nedeni bilinmeyen kronik inflamatuar granülomatöz
arterittir. Hastalık büyük ve orta boy arterleri tutar. Karotisler, subklavya,
brakiyosefalik arterler etkilenir. İntrakranial damarlar nadiren tutulur.
Sıklıkla 11-30 yaş arasındaki genç kadınlarda görülür, kadın erkek oranı
11:1dir. Hastalık semptomları sıklıkla 3.-4.
onyılda ortaya çıkar. En sık Asya toplumlarında rastlanır.
Yorgunluk, miyalji,
artralji, ateş, anemi ve kilo kaybı gibi akut faz belirtileri vardır. Aynı
dönemde veya daha sonra arterlerin stenoz ve oklüzyonlarına veya hipertansiyona
bağlı olarak hastaların yaklaşık %70inde kardiyovasküler ve serebrovasküler
belirtiler gelişir. İnme ve geçici iskemik atak %10-20 hastada gelişir.
Kol klodikasyosu,
baş dönmesi (dizziness) ve senkop en sık belirtilerdir. Baş dönmesi ve
senkop yatar pozisyondan oturur duruma geçme veya ayağa kalkma gibi postüral
değişikliklerden sonra ortaya çıkabilir. Geçici görme bulanıklığı, amorozis
fugaks gibi görsel belirtiler de erken dönemde sık görülür. Subklavya çalma
sendromu sık görülmesine karşın, muhtemelen Willis poligonunun iyi çalışması
sonucu arka sistem iskemisine pek rastlanmaz.
Beyin infarktına
hastalığın ileri dönemlerinde rastlanır. Radial nabzın palpe edilememesi
erken dönemde önemli bir belirtidir. Ayrıca her iki kol arasında belirgin
kan basıncı farkı saptanabilir. Kol ve bacak kan
basınçları arasında da asimetri görülür. Subklavyan arter stenozuna bağlı
olarak üst ekstremitelerde kan basıncı daha düşüktür. Hipertansiyona bağlı
olarak intraserebral kanamalar gelişebilir. Supraklaviküler bölge ve karotisler
üzerinde üfürüm duyulabilir. Konjestif kalp yetmezliği ve hipertansiyon gelişir.
Hipertansiyon en sık belirtilerden biridir
ve renal arterlerin stenozuna bağlıdır. Erken dönemde ve akut fazda sedimentasyon
hızı yüksektir. Sedimentasyon hızı sıklıkla kronik dönemde veya kortikosteroid
tedavisi ile normale döner. C-reaktif protein (CRP) hastalığın aktivitesini
izlemek açısından önemli bir indikatördür.
Erken ve akut
dönemde glikokortikoidlerin inflamasyonu önlemede etkili olduğu belirtilmiştir.
Siklofosfamid veya metotreksat, kortikosteroidlere iyi yanıt vermeyen hastalarda
kullanılabilir. Ayrıca steroidden kurtulma tedavisi olarak IL-6 reseptör
antagonisti tocolizumabın, serebrovasküler hastalık
gelişen hastalarda başarı ile kullanıldığı; steroid dozunun azaltılmasını,
bazı hastalarda kesilmesini ve klinik, laboratuvar, radyolojik düzelme sağladığı
bildirilmiştir. Kronik dönemde çeşitli cerrahi rekonstrüksiyonlar uygulanmaktadır.
Son zamanlarda renal arterlere ve beyin damarlarına stent uygulaması yapılmaktadır.
Hiperhomosisteinemi
Homosistinüri
başlıca sistationin beta sentaz eksikliğinin yol açtığı metiyonin metabolizması
bozukluğu sonucu ortaya çıkan, otozomal resesif bir bozukluktur. Serebral
arteryel ve venöz tromboz eğilimini arttırır. Sistatiyonin beta sentaz eksikliğinin
prevalansı 1/80.000-1/200.000 arasında değişmektedir, homozigot ve heterozigot
olmak üzere iki tipi vardır. Homozigot tipinde marfanoid tipte vücut yapısı,
lens dislokasyonu, mental retardasyon ve epileptik nöbetler görülür. Heterozigot
tipi veya edinsel metiyonin metobolizma bozuklukları sonucu ortaya çıkan
hiperhomosisteinemilerde inme riskinde artış görülür. Edinsel hiperhomosisteinemi
ileri yaş, hiperlipidemi, sigara, diabetes mellitus, kronik renal yetersizlik,
hipertansiyonla birlikte görülebilir. Ayrıca B6, folik asit, B12 gibi vitamin
eksikliğinde de ortaya çıkabilir. Plazma homosistein düzeyinin %25 düşük olmasının
inme riskinde %19 azalma ile ilişkili olduğu bulunmuştur. İnme ve diğer kardiyovasküler
hastalıklardan koruma amacıyla edinsel hiperhomosisteinemi tedavisinde, folik
asit, B12 ve B6 vitaminleri kullanılmıştır. Vitamin B12 ve folik asit verilmesinin
homosistein düzeylerini folik asit destekli yiyeceklerin kullanıldığı ülkelerde
%20, kullanılmadığı ülkelerde %30 azalttığı saptanmıştır. Ancak folik asit
ve B12 vitamin desteği verilen randomize çalışmaların meta-analizinde tedavinin
vasküler olay ve mortalite üzerinde etkisi olmadığı bulunmuştur. Başka bir
meta-analizde başlangıç homosistein düzeyi yüksek ve düşük olanlarda folik
asit tedavisini etkisi değerlendirilmiştir. Bu meta-analizde başlangıç hiperhomosisteinemisi
ve aterosklerotik yükü fazla olanlarda folik asitin hücre proliferasyonunu
arttırıcı etkisiyle ateroskleroz progresyonunu arttırdığı düşünülmüş ve folik
asit/B12 tedavisinin kardiyovasküler hastalık ve inmeyi önlemek için kullanılması
önerilmemiştir.
MELAS (Mitochondrial
Myopathy, Encephalopathy, Lactic Acidosis and Stroke
like Episodes)
MELAS, mitokondriyal
miyopati, ensefalopati, laktik asidoz, inmeye benzer ataklarla karakterize,
mitokondriyal DNAda mutasyon sonucu ortaya çıkan, herediter bir hastalıktır.
Kısa boy, tekrarlayan inmeye benzer ataklar, epilepsi, migren tipi başağrıları
başlıca belirtileridir. Migren tipi başağrıları inme ataklarından önce ortaya
çıkar. Hastalarda daha sonra demans gelişir. Çocuklarda, gençlerde veya orta
yaşlı kişilerde görülebilir. Serumda ve beyin omurilik sıvısında laktat düzeyi
yüksektir. BTde bazal ganglia kalsifikasyonu, serebral hemisferlerin gri
ve beyaz maddesinde hipodens alanlar vardır. Akut dönemde kitle etkisi olan
ve kontrast madde tutan bu lezyonlar daha sonra kaybolur. Kranial MRda,
difüzyon kısıtlılığı, ADC artmış veya azalmış olabilir, T2 ve FLAIRde hiperintenstir,
lezyonlar vasküler sulama alanlarına uymaz ve MR spektroskopide lezyonlarda
laktat düzeyi artmıştır. İnme benzeri ataklarda lezyonlar genellikle asimetriktir,
başlıca temporal, parietal ve oksipital loblarda korteksle sınırlıdırlar
veya subkortikal ak maddeyi de içerebilirler. Kas biyopsisinde, kasta mitokondriyal
hastalıkla uyumlu ragged red fiberlar görülür (Bakınız: Kas ve Nöromüsküler Kavşak Hastalıkları). İnme benzeri atakların vasküler endotel hücrelerinde
mitokondriyal proliferasyonun neden olduğu endotelyal disfonksiyon ve nitrik
oksit (NO) üretiminde azalmanın serebral mikrosirkülasyonda hipoperfüzyona
yol açması ile geliştiği düşünülmektedir. Tedavide NO prekürsörü arginin
ve sitrülin kullanımı ile inme benzeri atakların sıklığı ve ağırlığı azaltılabilir.
CADASIL (Cerebral Autosomal Dominant Arteriopathy
with Subcortical Infarcts and Leukoencephalopathy)
En sık görülen
kalıtsal serebral küçük damar hastalığı CADASILdir. Daha nadir olarak subkortikal
infarktlarla birlikte serebral otozomal resesif lökoensefalopati (CARASIL)
ve COL-4A mutasyonlarıyla ilişkili lökoensefalopati sayılabilir. CADASIL
19. kromozomdaki Notch3 geninde (en sık 2-6. ekzonlarda) sistein
kalıntılarında değişikliğe yol açan mutasyon sonucu ortaya çıkan herediter,
otozomal dominant, küçük damarları tutan bir hastalıktır. Ortalama 45-50
yaşlarda başlayan ve tekrarlayan iskemik ataklar görülür. İskemik belirtiler
GİA veya laküner inme şeklindedir. Yürütücü işlevler, dikkat, bellek, dil
ve görsel-mekansal bozukluklarla başlayan kognitif
bozulma demansa ilerler. Hastaların %40ında auralı veya aurasız migren atakları
vardır. Bunlar hastalığın ilk belirtisi olabilir. İskemik belirtilerin görülmesinden
yıllar önce psikiyatrik belirtiler ve davranış değişiklikleri görülebilir.
Lezyonlar subkortikal ak maddede olmasına rağmen nöbetler de görülebilir.
MR hastalığın
tanısında çok önemlidir. Semptomatik kişilerde hemen daima patolojiktir.
MRda patolojik sinyal değişiklikleri hasta semptomatik olmadan önce de saptanabilir.
MRde subkortikal beyaz maddede ve bazal gangliada küçük derin infarktlar
görülür. CADASILde kortikal tutulum ve infratentoryal lezyonlar çok nadirdir.
Ayrıca periventriküler ve subkortikal beyaz maddede fokal veya diffüz patolojik
sinyal artışı vardır. Temporal loblarda görülebilen patolojik sinyal değişikliği
ayırıcı tanıda önemlidir.
Beynin perforan
ve leptomenengial damarlarında medya tabakasında eozinofilik materyal depolanması
vardır, lümen küçülmüştür, damar duvarı kalınlaşmıştır. Elektron mikroskobunda
etkilenen damarların bazal laminasında granüler osmofilik materyal birikimi
gösterilmiştir. Benzer değişiklikler deri, kas ve sinirde de bulunabilir.
Hastalığın bilinen bir tedavisi yoktur.
Gebelik ve Puerperium
Hamilelik döneminde
ve postpartum (daha sık olarak doğumdan sonraki 6 haftalık dönemde) inme
nispeten nadirdir, ancak yüksek morbidite ve mortalite ile ilişkilidir ve
son yılarda muhtemelen gebeliğin hipertansif hastalıklarındaki artış nedeniyle
insidansta artış bildirilmektedir. Batılı kadınların %1618'i ve Asyalıların
%11'inde 35 yaşın altındaki kadınlarda (pre) eklampsi dahil olmak üzere büyük çoğunluğu hipertansiyonla ilişkili
risk faktörleri, HELLP sendromu ve hiperkoagülabl durum nedeniyle iskemik
inme gelişir. Fakat gebelik ve puerperium döneminde inme geçiren kadınların
yaklaşık ¼ünde inme nedeni belirlenememektedir. Yaşlılarda daha sık izlenen
etiyolojik nedenlerden olan büyük arter hastalığı ve kardiyoembolinin yanı
sıra, arteryel diseksiyon, hiperkoagülabilite ve (pre)eklampsi gençlerdeki
başlıca etyolojik nedenler olarak sıralanabilir.
Gebelik sırasında
kan hacmi ve kardiyak outputta artış, kardiyak remodeling, vazodilatasyon
gibi değişikliklere uyum sağlayamama, özellikle bilinen kalp hastalığı olan
gebe kadınlarda kardiyovasküler komplikasyon riskini
arttırır ve önceden bilinmeyen kardiyak hastalıkların ortaya çıkmasına neden
olur. Üçüncü trimesterden 6. aya kadar olan dönemde ortaya çıkan ve mekanizması
iyi bilinmeyen peripartum kardiyomiyopati, gebeliğe özgü bir dilate kardiyomiyopatidir.
Romatizmal kalp kapak hastalığına bağlı komplikasyonlar da ülkemiz gibi bu
hastalığın halen sık görüldüğü ülkelerde, hamileliğe bağlı inmenin başlıca
nedenlerinden biri olarak karşımıza çıkmaktadır.
Özellikle 3. trimester
ve postpartum dönemde gebeliğe bağlı fizyolojik hiperkoagülabilite ile birlikte
olan edinsel veya herediter bir hiperkoagülabilite nedeni iskemik inme riskini
arttırır. Gebeliğin hipertansif hastalıkları içinde gestasyonel hipertansiyon,
(pre)eklampsi, HELLP sendromu (hemoliz, karaciğer enzim yüksekliği, düşük
trombosit sendromu) bulunur. Bu hastalıkların patofizyolojisi tam olarak
aydınlatılmamıştır. Sistemik endotelyal hasar, kan akımı regülasyonundaki bozukluklar, uterovasküler gelişimin
inhibisyonu ve oksidatif stresin bu hastalıkta sorumlu olduğu öne sürülmektedir.
Gebeliğin hipertansif
hastalıkları, gebelerde en sık saptanan inme etyolojisidir ve bu dönemdeki
tüm inmelerin (tıkayıcı ve iskemik) %25-57sinden sorumludur. Preeklampsi
20 haftalık hamilelikten sonra gelişen yeni başlangıçlı arteryel hipertansiyon
(>140/90 mmHg) ve proteinüri (>300 mg/gün) ile karakterizedir. Ödem
ve üçüncü trimesterde aşırı kilo artışı (> 1kg / hafta) olabilir, ancak
bu tanı için gerekli değildir. Pre-eklampsi % 5-8 gebelikte görülür ve dünya
çapında yıllık 50000 ölüme neden olur. Preeklampsi için risk faktörleri obezite,
daha önceden preeklampsi veya eklampsi öyküsü, insülin direnci, hiperlipidemi,
hipertansiyon, böbrek hastalığı ve trombofilidir. Nörolojik semptomlar baş
ağrısı, konfüzyon, görme bozuklukları ve iskemik veya hemorajik inmeyi içerir.
Sistemik belirtiler ise böbrek yetmezliği, pulmoner ödem, epigastrik veya
sağ üst kadran ağrısı, hemoliz ve HELLP sendromudur. (Pre)eklampsi kaynaklı
HELLP, ağır olgulardaki kan pıhtılaşmasının aktivasyonu ile bağlantılı çeşitli
organlarda makroskopik fibrin birikimleri ile ilişkilendirilmektedir. Bu
peripartum hemostatik acil durumlara bağlı gelişen yaygın intravasküler pıhtılaşma
(DİK) hastaların % 1-5'inde gelişebilir, ayrıca abruptio plasenta ve ölü
fetüs sendromuna yol açabilir.
Eklampsi, preeklampsili
hastada başka provokatif faktör olmaksızın epileptik bir nöbet meydana gelmesi
ile tanımlanır. Tedavide magnezyum sülfatın tekrarlayan nöbetleri önlemede
genellikle diazepam ve fenitoinden daha etkili olduğu gösterilmiştir. Ancak
başlangıçta magnezyum sülfata yanıt vermeyen nöbetleri kontrol altına almak
için tedaviye diazepam veya lorazepam eklemek gerekebilir. Hidralazin veya
labetalol, kontrol edilmeyen hipertansiyon için kullanılabilir. Doğum genellikle
sorunların gerilemesine yol açar ancak, eklampsili kadınların % 10-45inde
doğumu izleyen 2 ila 48 gün arasında anjiyopati [Reversible serbral vasokonstriksiyon
sendomu (RCVS)] ile ilişkili gecikmiş eklampsi görülebilir. RCVS, intravasküler
tonus değişikliklerinin yol açtığı yaygın ve geçici bir serebral vazospazm
tablosudur. Fokal nörolojik defisitlere ve sıklıkla akut iskemik inme ve
kortikal subaraknoid kanamaya yol açan RCVS, normal bir gebelik ve doğum
sonrasında postpartum geçici vazokonstriksiyon nedeniyle de gelişebilir.
Hastalarda gökgürültüsü başağrısı, ağır olgularda nörolojik defisitler görülür.
Posterior reversible ensefalopati sendromu (PRES) ise hipertansiyon ve endotel
disfonksiyonu ile tetiklendiği düşünülen vazojenik beyin ödemidir. Hastalar
tipik olarak başağrısı ve ensefalopati tablosu, eşlik eden nöbetler, görme
alanı defektlerinden kortikal körlüğe kadar gidebilen semptomlarla başvururlar.
Risk faktörleri, tedavi edilmemiş hipertansiyon (çoğunlukla preeklampsi varlığında),
böbrek yetersizliği, otoimmün hastalık ve sitotoksik ilaçlardır. RCVS, PRES
ve (pre)eklamsi önemli ölçüde çakışan tablolardır, patofizyolojilerinin ortak
veya farklı olabileceği konusundaki fikir birliği yoktur. Her iki tablo
da geçici ve geri dönüşümlü olabileceği gibi inmeye yol açarak kalıcı nörolojik
defisitlere yol açabilir.
Çok nadir olarak
koryokarsinoma bağlı trofoblastik embolizim veya doğrudan endovasküler hasar
ve amniyotik sıvı embolisi de gebelik ve puerperiumda akut iskemik inmeye
neden olabilir.
Tanı
için fetusu iyonizan radyasyon ve kontrast madde toksisitesinden koruma maçı
ile MR ve TOF yöntemiyle MR Anjiyografi tercih edilmelidir. Fakat başka nedenlerle
MR yapılamıyorsa fetusa zarar verecek dozların altında olacak şekilde BT
ve BT Anjiyografi de yapılabilir. Laktasyon döneminde kontast maddelerin
süte geçişi olmadığından kontrastlı incelemeler yapılabilir ve laktasyon
sürdürülebilir. Akut iskemik inme tedavilerinden intravenöz trombolitik tedavi
ve mekanik trombekomi çalışmalarında gebelik ve puerperium dönemindeki kadınlar
çalışmalar dahil edilmediğinden klinik çalışma verisi olmasa da bu dönemde
de akut iskemik inme tedavilerinin güvenle uygulanabileceğini bildiren olgu
serileri vardır. Antiplatelet tedavilerden asetilsalisilik asitin (ASA) 50-150
mg/gün dozlarında 2. ve 3. trimesterde ve laktasyon döneminde güvenle kullanılabileceği
bilinmektedir. ASAnın, birinci trimesterde bazı fetal anomalilerle (gastroşizis
gibi) ilişkili olduğunu bildiren bazı çalışmalar olsa da fetal anomalilerle
ilişki olmadığını bildirenler de vardır. Gebeliğin 36. haftasında veya planlı
bir doğumdan en az 1 hafta önce kanama komplikasyonlarından kaçınmak için
ASA tedavisi kesilmelidir. Diğer antiplatelet ajanlar (dipridamol, klopidogrel,
tikagrelor) ile ilgili yeterli veri olmadığından kullanılmamalıdırlar. Antikoagülan
tedavi gerektiğinde plasentayı geçtiği için warfarin ve yeni oral antikoagülanlar
kullanılmamalıdır. Warfarin, laktasyon döneminde kullanılabilir. Gebelik
sırasında antikoagülan tedavi gerektiğinde plasentaya geçmedikleri için heparin
ve düşük molekül ağırlıklı heparinler tercih edilmelidir. Doğumdan 24 saat
önce heparinler kesilmelidir, doğumdan 12-24 saat sonra heparin, 1-3 gün
sonra varfarin başlanabilir. Antihipertansiflerin neredeyse hepsi plasentaya
geçtikleri için sık kullanılan ajanlardan anjiyotensin reseptör blokerleri,
direkt renin inhibitörleri kontrendikedir, en güvenli ve etkili ajanlar
olan labetalol, nifedipin ve metildopa kulanılabilir. İskemik inmeli gebelerde
doğum yöntemi konusunda çalışma olmadığından obstetrik bir endikasyon yoksa
vajinal doğum yapılabilir. (Pre)eklampsi ve HELLP sendromu nedeniyle inme
gelişirse, mümkün olan en kısa zamanda doğum indüksiyonu yapılmalıdır.
Gebelik ve puerperiumda
inme izlenen bir hamilelikten sonraki bir hamilelikte tekrarlayan iskemik
inmenin mutlak riski düşüktür (% 0-% 0,1). Genel olarak sonraki doğumlarda,
doğum sonrası dönem yüksek rekürrens riski ile ilişkili bulunmuştur ve bu
risk altta yatan neden veya hastalıklara bağlıdır. Özellikle antifosfolipid
sendromu nedeniyle inme geçiren kadınlarda inmenin
tekrarlama riski yüksek (% 15) bulunmuştur. Bu konuyla ilgili (sınırlı) bulgulara
dayanarak gelecek gebelikler için cesaret kırılması gerekmez ancak danışmanlık
verilmelidir.
KAYNAKLAR
- APASS
GROUP. Antiphospholipid Antibodies in Stroke Study Group: Clinical and
laboratory findings in patients with antiphospolipid antibodies and
cerebral ischemia. Stroke 1990; 21:1268-73.
- Antiphospholipid
Antibodies in Stroke Study (APASS) Group. Anticardiolipin antibodies
are an independent risk factor for first ischemic stroke. Neurology
1993; 43:2069-73.
- Barnet
HJM, Mohr SP, Stein BM, Yatsu FM (editörler): Stroke. Pathophysiology,
Diagnosis and Management New York, Churchill Livingstone, 1998.
- Bogousslavsky
J, Caplan LR (editörler): Stroke Syndromes. Cambridge, Cambridge University
Press, 2001.
- Bogousslavsky
J, Caplan L (editörler): Uncommon Causes of Stroke. Cambridge, Cambridge
University Press, 2001.
- Caplan
R (editör): Uncommon Causes of Stroke. Cambridge, Cambridge University
Press, 2008.
- De
Amorim LCD, Maia FM, Rodrigues CEM: Stroke in systemic lupus erythematosus and
antiphospholipid syndrome: risk factors, clinical manifestations, neuroimaging,
and
treatment . Lupus 2017;26:529-53.
7.
Duarte MM, Geraldes R, Sousa R, Alarcao J, Costa J: Stroke and transient ischemic attack in Takayasus
Arteritis: A systematic review and meta-analysis. J Stroke Cerebrovasc Dis
2016;25:781-91.
8.
El-Hattab AW, Adesina AM, Jones
J, Scaglia F. MELAS syndrome: Clinical manifestations, pathogenesis, and
treatment options. Molecular Genetics and Metabolism 2015; 116:4-12.
9.
Engelter S, Traenka C, Lyrer P.
Dissection of cerebral and cervical arteries: Curr Neurol Neurosci Rep 2017;17:50-9.
10.
Fisher M (editör): Clinical Atlas
of Cerebrovascular Disorders. London, Mosby, 1994.
11.
Guey S, Tournier-Lasserve E, Hervé D,
Kossorotoff M. Moyamoya disease and syndromes: from genetics to clinical
management. Appl Clin Genet 2015;8:4968.
12.
Krishnamurthi RV, Moran AE, Feigin VL, Barker-Collo S,Norrving B, Mensah GA,
ve ark. Stroke Prevalence, Mortality and Disability-Adjusted Life
Years in Adults Aged 20-64 Years in1990-2013: Data from the Global Burden
of Disease 2013 Study. Neuroepidemiology 2015; 45: 190-202.
13.
Mohr JP ,Choi
DW ,Grotta JC ,Weir B , Wolf PA (editörler): Stroke . Pathophysiology , Diagnosis and Management (4th ed
). New York, Churchill Livingstone, 2004
14.
Putaala J. Ischemic stroke
in the young: Current perspectives on incidence, risk factors, and cardiovascular
prognosis 2016;1:28-40.
15.
Warlow CP,Dennis
MS, van Gijn J, Hankey GT, Sandercock PAG, Bamford JM, Wardlaw J (editörler):
Stroke: A Practical Guide to Management. Oxford, Blackwell Science, 2008.