OTONOM
SİNİR SİSTEMİ HASTALIKLARI
Yazanlar: Görkem Şirin, Barış Baslo
Son
güncelleştirme tarihi: 23.03.2019
Otonom sinir sistemi, sinir sisteminin
bilinçli kontrol olmadan kendi kendine çalışan kısımlarını tanımlamak için
kullanılır. İstemli kaslar dışındaki tüm dokuların otonom sinir sistemi bağlantıları
bulunmaktadır. Merkezi sinir sistemi içerisinde oldukça geniş bir ağ yapısına
sahiptir ve buna merkezi otonomik ağ denilmektedir. Ayrıca merkezi sinir
sisteminden çıkıp son organa ulaşan periferik otonom sinir sistemi bulunur.
Bu bölümde, otonom sinir sisteminin anatomisi, görevleri, otonom sinir sistemi
disfonksiyonu ile seyreden nörolojik ve sistemik hastalıklar ve otonom sinir
sistemi disfonksiyonu olan hastaya yaklaşımdan bahsedilecektir.
ANATOMİ
Merkezi Otonomik Ağ
Merkezi sinir sistemi içerisinde
yer alan ve otonom sinir sisteminin preganglionik sempatik ve parasempatik
nöronlarının kontrol ve modülasyonunu sağlayan bağlantıları içerir. Merkezi
otonomik ağın görevi, viseral organlardan gelen afferent bilgileri toplayarak
vücudun fizyolojik durumunu algılamak ve gerekli otonom cevabı düzenlemektedir.
Dört seviyeden oluşur: ön beyin, bulbopontin, pontomezensefalik ve spinal
(Tablo 1).
Tablo 1. Merkezi otonomik ağ ve görevleri
(Kaynak 1’den değiştirilerek)
|
|
Görevleri |
|
Ön beyin Anterior singulat korteks Amigdala İnsula Hipotalamus |
Duygusal ve davranışsal kontrol Davranışsal uyanma (arousal)
kontrolü Stres cevabı Homeostaz |
|
Pontomezensefalik sistem Preakuaduktal gri madde |
Uyanıklık sisteminin otonom kontrolü Ağrı modülasyonu Stres cevabının modülasyonu |
|
Bulbopontin sistem Traktus solitarius çekirdeği Ventral medulla retiküler formasyon Parabrakiyal çekirdek Medulla raphe çekirdeği Barrington çekirdeği |
Kan basıncının kontrolü Solunum ritminin kontrolü Dolaşım, solunum, miksiyon ve
gastrointestinal sistemlerin otonom reflekslerinin kontrolü |
|
Spinal Intermediolateral hücre kolonu Sakral parasempatik çekirdekler |
Segmenter sempatik ve sakral
parasempatik reflekslerin kontrolü |
İnsular korteks, amigdala ve anterior
singulat korteks viseral duysal girdilere kognitif ve emosyonel cevabın düzenlenmesi
ve uyanıklık, dikkat ve davranışsal bütünlüğün sağlanmasında görev yaparken
hipotalamus daha çok homeostaz ile görevlidir. Hipotalamusun çeşitli bölgeleri
farklı görevleri gerçekleştirir (Tablo 2).
Tablo 2. Hipotalamusun otonom sistemle
ilişkili çekirdekleri ve görevleri (Kaynak
1’den değiştirilerek)
|
|
Görevleri |
|
Paraventiküler çekirdek |
Stres yanıtını kontrol eder Antidiüretik hormonun salınmasını
sağlar Su ve tuz alımını kontrol eder |
|
Dorsomedial çekirdek |
Stres yanıtını kontrol eder Termoregülasyonda rol oynar Kardiyovasküler kontrolde rol oynar |
|
Posterolateral hipotalamus |
Hipokretin salınımı ile birlikte
uyanıklık, beslenme ve ödül sistemi ilişkili kontrolü sağlar |
|
Medial preoptik çekirdek |
Termoregülasyon kontrolünde rol
oynar |
Beyinsapında bulunan otonom sinir
sistemiyle ilişkili alanlar (Tablo 1) ağrı modülasyonu, uyku-uyanıklık
döngüsünün kontrolü, termoregülasyon, solunum ve kardiyak sistem kontrolünde
görev alırlar. Miksiyon kontrolünde görev alan Barrington çekirdeği, pelvik
organlardan girdi alır ve pontin miksiyon merkezi olarak da bilini,. Traktus
solitarius çekirdeği, tat reseptörleri, kardiyak baroreseptörler ve pulmoner
kemoreseptörlerden girdi alır ve önemli pulmoner ve kardiyovasküler otonom
reflekslerde rol oynar.
Merkezi otonomik ağ viseral efferentler,
nosiseptör, termoreseptör ve kas reseptörlerinden girdi alır. Ayrıca 3. ve
4. ventrikül çevresinde bulunan ve kan-beyin bariyeri bulunmaması nedeniyle
kan içerisindeki kimyasal değişiklere duyarlı sirkumventriküler organlarla
da ilişki halindedir. Merkezi otonom ağın çıktıları ise T1-L2 medulla spinalis
seviyelerinde bulunan sempatik preganglionik nöronlar ve beyinsapı ve sakral
medulla spinaliste bulunan parasempatik preganglionik nöronlara iletilir.
Periferik Otonom
Sinir Sistemi
Periferik otonom sinir sistemi,
parasempatik, sempatik ve enterik otonom sinir sisteminden oluşur. Parasempatik
ve sempatik otonom sinir sisteminin preganglionik ve postganglionik olmak
üzere iki adet nöronu bulunur. Tüm preganglionik nöronlar transmitter olarak
asetilkolin (ACh) kullanırlar ve ince miyelinlidir. Tüm postganglionik nöronlar
miyelinsizdir. Parasempatik postganglionik nöronlar nörotransmitter olarak
ACh kullanırken sempatik paraganglionik nöronların büyük kısmı norepinefrini
kullanır. Az sayıda kolinerjik sempatik postganglionik nöronlar ter bezlerini
ve piloerektör kasları innerve eder. Adrenal medullanın endokrin hücreleri
dolaşım sistemine epinefrin salgılar. Bazı parasempatik postganglionik nöronlar
vazoaktif intestinal polipeptit (VIP) ve/veya nitrik oksiti (NO) nörotransmitter
olarak kullanabilirler. Parasempatik ganglionlar hedef organın yakınında
oldukları için, preganglionik nöronların aksonları uzun iken postganglionik
nöronların aksonları kısadır. Ganglionları merkezi sinir sisteminin yakınında
olan sempatik otonom sinir sisteminde ise, preganglionik nöronların aksonları
kısa iken postganglionik nöronların aksonları uzundur (Şekil 1).
Enterik otonom sinir sistemi ise, gastrointestinal sistemin intrinsik otonom
kontrolünü sağlar ve miyenterik ve submukozal pleksustan oluşur.
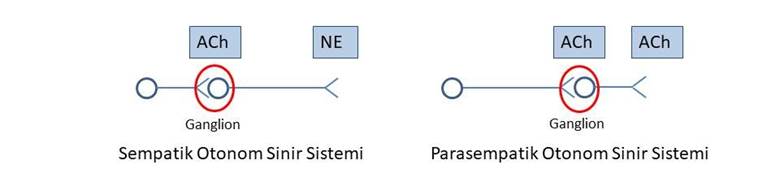
Şekil
1.
Sempatik ve parasempatik otonom sinir sisteminin preganglionik ve postganglionik
nöronlarının yapısı. ACh, asetilkolin; NE, norepinefrin.
Sempatik Otonom
Sinir Sisteminin Anatomisi ve Fonksiyonları
Sempatik otonom sinir sisteminin
preganglionik nöronları T1 ile L2 medulla spinalis segmentleri arasında intermediolateral
hücre kolonunda Lamina VII’de bulunurlar (Şekil 2). Bu nöronların
rostrakaudal yönde segmenter organizasyonu mevcuttur (Tablo
3). Preganglionik sempatik nöronların aksonları medulla spinalisi ön
kök ile terk ederler ve hemen sonrasında beyaz birleştirici ramuslar (white
rami comminicantes) adı verilen bağlantıya girerek paravertebral gangliona
ulaşırlar. Paravertebral ganglionlar vertebranın her iki kenarında bulunurlar
ve bir üstteki ve alttaki ganglion ile bağlantılıdırlar. Bu nedenle bu yapıya
paravertebral sempatik zincir de denilmektedir (Şekil 2).
Preganglionik aksonlar bu aşamadan sonra birkaç farklı yol ile hedef organlarına
ulaşırlar. Preganglionik aksonların bir kısmı, paravertebral ganglionlarda
sinaps yapar. Sinaps yaptıkları paravertebral ganglion, medulla spinalisten
çıktıkları segment ile aynı seviyede olabileceği gibi daha sıklıkla birkaç
seviye rostral veya kaudalindeki paravertebral gangliondur. Paravertebral
ganglionda sinaps yaptıkları postganglionik nöronların aksonlarıysa, ganglionu
gri birleştirici ramuslar (grey rami comminicantes)adı verilen bağlantı ile
terk ederler ve tekrar spinal sinirlere karışırlar. Paravertebral ganglion
ile spinal sinirin ön kökünü birbirine bağlayan bu bağlantılardan ilki preganglionik
sempatik lifleri taşır ve bu lifler ince miyelinli olduğu için beyaz (white)
olarak adlandırılmıştır. Oysa ikincisi postganglionik sempatik aksonları içerir
ve bu aksonlar miyelinsiz olduklarından gri (grey) olarak isimlendirilirler.
Spinal sinirler içerisinde seyreden sempatik lifler ilgili segmenter bölgelere
(servikal, torakal ve lumbar) giderek o bölgedeki sudomotor, vazomotor ve
pilomotor görevleri yerine getirirler. Paravertebral ganglionlarda innerve
edilen postganglionik nöronların aksonlarının bir kısmı ise spinal sinirlere
katılmaz, bu aksonlar sempatik sinirler aracılığı ile paravertebral ganglionu
terk eder ve baş-boyun ve torakal bölgede bulunan viseral organların sempatik
innervasyonunu sağlarlar. Hedef organlara giderken ilgili damarlar ile beraber
seyrederler. Preganglionik sempatik aksonların izlediği bir diğer yolda ise,
bu aksonlar paravertebral ganglionda sinaps yapmadan splanknik sinir adı verilen
sempatik sinirler aracılığıyla prevertebral ganglionlara (kollateral ganglion
da denilmektedir) ulaşırlar. Bu ganglionlar; çölyak, superior ve inferior
mezenterik ganglionlardır ve postganglionik aksonları, abdominal ve pelvik
kavitedeki viseral organların sempatik innervasyonunu sağlarlar (Tablo 3). T5-T12 segmentlerinden çıkan preganglionik aksonların
bir kısmı ganglionlarda sinaps yapmadan doğrudan adrenal medullaya gelir ve
buradaki kromaffin hücreler ile sinaps yaparlar. Bu hücreler postganglionik
nöron yapısındadır ancak farklılıkları ağırlıklı olarak epinefrin salgılamalarıdır.
Sonuç olarak, adrenal medulla sempatik ganglion görevi yapmaktadır.
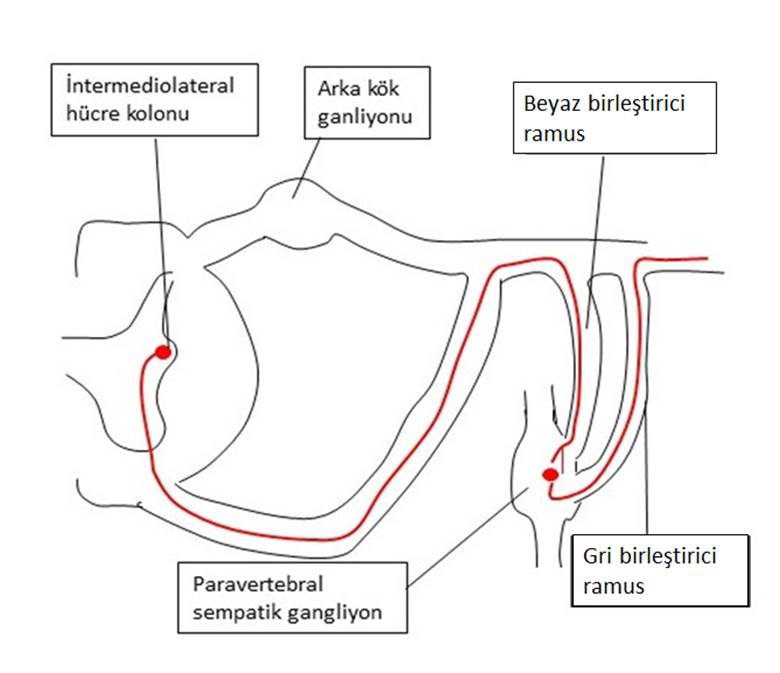
Şekil
2. Sempatik
sinir sistemi medulla spinalis kesiti
Sempatik otonom sinir sistemi stres,
soğuk veya sıcağa maruz kalma, emosyon, egzersiz, kanama gibi belirli uyaranlara
cevap olarak aktive olur. Tablo 3’te sempatik otonom sinir
sisteminin hedef organlarda oluşturduğu cevaplar özetlenmiştir.
Tablo
3.
Sempatik otonom sinir sisteminin fonksiyonu ve anatomisi (Kaynak
1 ve 3’ten değiştirilerek)
|
Spinal seviye |
Ganglion |
Hedef organ |
Fonksiyonu |
|
T1-T3 |
·
Superior servikal
ganglion |
Baş boyun-spinal
ve sempatik sinir ·
Göz ·
Tükürük ve ter
bezleri ·
Pineal bez ·
Damar duvarları |
·
Vazomotor ve
sudomotor fonksiyon ·
Pupil dilatasyonu ·
Tarsal kas kasılması ·
Tükürük salgısında
protein artışı ·
Melatonin salınımı |
|
T1-T8 |
·
Satellit ganglion* ·
Torakal paravertebral
ganglion |
Torakal ve üst
ekstremite-spinal ve sempatik sinir ·
Ter bezleri ·
Damar duvarları ·
Piloerektör kas ·
Kalp ·
Solunum sistemi |
·
Vazomotor, pilomotor
ve sudomotor fonksiyon ·
Kalp hızında
artma ·
Bronkodilatasyon |
|
T5-L2 |
·
Prevertebral ganglion
(çölyak, inferior ve superior mezenterik) ·
Adrenal medulla
(T5-T12) |
Abdominal ve pelvik
kavite-splanknik sinirler ·
Abdominal ve
pelvik viseral organlar |
·
Gastrointestinal
sistem motilitesinde azalma ·
Rektal inhibisyon ·
Üriner retansiyon ·
Ejakülasyon ·
Epinefrin salınımı |
|
T10-T12 |
·
Lomber paravertebral
ganglion |
Lomber spinal sinirler |
·
Vazomotor, pilomotor
ve sudomotor fonksiyon |
*Satellit ganglion,
inferior servikal ve 1. torakal paravertebral ganglionun birleşmesi ile oluşur,
insanların %80’inde vardır.
Parasempatik Otonom
Sinir sisteminin Anatomisi ve Fonksiyonları
Parasempatik preganglionik nöronlar
beyinsapında kranial parasempatik çekirdeklerde ve sakral medulla spinaliste
(S2-S4) intermediolateral hücre kolonunda bulunurlar. Parasempatik otonom
sinir sistemi, sempatik otonom sinir sisteminin aksine belirli durumlarda
aktive olmaz, duysal girdilere yanıt olarak çeşitli refleks cevapları oluştururlar.
Yukarıda bahsedildiği gibi, parasempatik otonom sinir sisteminin ganglionları
hedef organın yakınında bulunur. Tablo 4’te parasempatik
otonom sinir sisteminin anatomik bağlantıları ve fonksiyonları özetlenmiştir.
Parasempatik otonom sinir sistemi nörotransmitter olarak ACh, NO veya VIP
kullanabilir. ACh, hedef organda kardiyak inhibisyon, sekresyonlarda artma,
düz kaslarda kasılmaya neden olurken VIP ve NO düz kaslarda gevşemeye neden
olur.
Tablo
4.
Parasempatik otonom sinir sistemi anatomisi ve fonksiyonları (Kaynak
1’den değiştirilerek)
|
Preganglionik nöron-akson |
Ganglion |
Hedef organ |
Fonksiyonu |
|
Edinger-Westphal
çekirdeği 3. kranial sinir |
·
Silier ganglion |
Göz ·
İris sfinkter kası ·
Silier kas |
·
Pupil konstriksiyonu ·
Akomodasyon |
|
Superior salivatuar
çekirdek 7. kranial sinir |
·
Pterigopalatin
ganglion ·
Submandibular
ganglion |
·
Submandibular bez ·
Sublingual bez ·
Lakrimal bezler ·
Nazal mukoza ·
Damar duvarı |
·
Salya artışı ·
Lakrimasyon ·
Vazodilatasyon |
|
İnferior salivatuar
çekirdek 9. kranial sinir |
·
Otik ganglion |
·
Parotis bezi ·
Damar duvarı |
·
Salya artışı ·
Vazodilatasyon |
|
Vagusun dorsal
motor çekirdeği 10. kranial sinir
|
·
Özefageal pleksus ·
Pulmoner pleksus ·
Miyenterik pleksus ·
Submukozal pleksus |
·
Gastrointestinal
sistem ·
Pulmoner yapılar |
·
Bronkokonstriksiyon ·
Sekresyonlarda
artış ·
Peristaltizmde
artış ·
Sfinkterlerde gevşeme |
|
Ambiguus çekirdeği 10. kranial sinir |
·
Kardiyak pleksus |
·
Kalp |
·
Kalp hızında azalma ·
Atriyoventriküler
iletimde azalma |
|
S2-S4 intermediolateral
kolon |
·
İntramural ganglion |
·
Mesane ·
Rektum ·
Penis |
·
Detrusor kasta
kasılma ·
Mesane boynunda
gevşeme ·
Rektum boşaltımı-defekasyon ·
Penil düz kasta
gevşeme |
Enterik otonom sinir sistemi, bağırsak
duvarının iki yüzü arasında yer alan iki adet ganglion da içeren pleksustan
oluşur. Bunlar miyenterik pleksus (Auerbach pleksusu) ve submukozal pleksus
(Meissner pleksusu)’dur. Bu iki pleksus merkezi sinir sisteminden bağımsız
olarak, bağırsak duvarının gerilmesi, distorsiyonu veya içeriğinin kimyasal
yapısına bağlı aktive olur. Ayrıca parasempatik ve sempatik otonom sinir
sistemi ile bağlantı halindedir. Parasempatik otonom sinir sistemine benzer
şekilde nörotransmitter olarak ACh, NO ve VIP kullanır.
OTONOM DİSFONKSİYONU OLAN HASTAYA
YAKLAŞIM
Otonom disfonksiyonun değerlendirilmesi
sırasında şu soruların cevaplanması yol gösterici olacaktır:
1)
Hastada otonom disfonksiyon var
mı?
2)
Otonom disfonksiyon iyi bilinen
fokal bir sendrom (örneğin, Horner sendromu veya Sicca sendromundaki ağız
ve göz kuruluğu) mu yoksa jeneralize bir disfonksiyon mu var?
3)
Otonom disfonksiyona neden olan
bir ilaç kullanımı var mı?
4)
Otonom disfonksiyon hangi alt birimleri
etkilemiş: sempatik, parasempatik veya enterik otonom sinir sistemi?
5)
Otonom disfonksiyonun başlangıcı
ve seyri nasıl: akut, subakut veya kronik, stabil veya progresif?
6)
Otonom disfonksiyon merkezi veya
periferik sinir sisteminin etkilenmesi sonucu mu oluşmuş?
7)
Otonom disfonksiyona eşlik eden
başka bir nörolojik sendrom (örneğin, parkinsonizm veya periferik nöropati)
var mı?
Otonom disfonksiyonun varlığının
tespit edilmesi, otonom disfonksiyonun klinik bulgularının iyi tanınması
ile mümkündür (Tablo 5). Bu bulgular hastalara özellikle sorulmadıkça
gözden kaçabilir. Bu amaçla çeşitli anketlerin anamnez sırasında uygulanması
klinisyene yol gösterici olacaktır. Bu anketlerden en yaygın olarak kullanılanları
Compass-31 ve ince lif nöropatisi semptom değerlendirme anketi (SFN-SIQ)’dir.
Compass-31, ayağa kalkınca sersemlik hissi, göz kuruluğu, ağız kuruluğu,
ciltte renk değişikliği, terleme değişliği, yemek yerken doygunluk süresi,
yemek sonrası kusma, ishal, kabızlık, karın ağrısı, idrar yaparken güçlük,
boşaltamama hissi, ışık hassasiyeti, bulanık görme-odaklanamama gibi semptomları
sorgulayan ve her semptomun sıklığı ve günlük yaşam aktivitelerini ne kadar
etkilediği sınayan 31 sorudan oluşan bir ankettir. Bu şekilde otonom disfonksiyonun
varlığı ve şiddetinin kantitatif bir değerlendirilmesi yapılabilmektedir.
SFN-SIQ ise, ince lif nöropatilerinin değerlendirilmesinde kullanılır ve
ağrı-ısı duyularının etkilenmesine dair klinik bulguları da içerir (Tablo 6). Bu skorlamada 2 ve daha fazla semptomun bulunması
ince lif nöropatisi varlığını düşündürür.
Tablo 5. Otonom disfonksiyonun klinik bulguları
(Kaynak
1 ve 3’ten değiştirilerek)
|
Göz ·
Bulanık görme ·
Göz kuruluğu ·
Işık hassasiyeti ·
Pupil ışık cevabı ·
Ptoz ·
Gözyaşında artma |
|
Kardiyovasküler ·
Ortostatik hipotansiyon ·
Postprandial hipotansiyon ·
Postüral otonom taşikardi sendromu ·
Ortostatik intolerans ·
Paroksismal hipertansiyon ·
Taşikardi, bradikardi ·
Otonom disrefleksi |
|
Sudomotor-termoregülasyon ·
Anhidrozis ·
Hiperhidrozis ·
Cilt kuruluğu ·
Sıcak intoleransı |
|
Pulmoner ·
Uyku apnesi ·
Hipoventilasyon |
|
Gastrointestinal sistem ·
Ağız kuruluğu ·
Salya artışı ·
Hazımsızlık, şişkinlik ·
Konstipasyon ·
Diyare ·
Postprandial anjina ·
Erken doygunluk hissi ·
Kilo kaybı ·
Bulantı, kusma |
|
Üriner sistem ·
Noktüri ·
Acil idrar yapma isteği (urgency) ·
Üriner retansiyon ·
Üriner inkontinans ·
Enürezis |
|
Cinsel ·
Ereksiyon veya ejakülasyon bozukluğu ·
Retrograd ejakülasyon ·
Vajinal kayganlıkta azalma ·
Orgazm olamama |
Tablo 6. İnce lif nöropatisi semptom değerlendirme
anketi (SFN-SIQ) (Kaynak 5’ten alınmıştır)
|
Duysal ·
Periferik ağrı ·
Parestezi ·
Allodini ·
Ağrı hassasiyeti ·
Isı hassasiyeti |
|
Otonom ·
Göz veya ağız kuruluğu ·
Akomodasyon kusuru ·
Hiper/hipohidrozis ·
Miksiyon bozuklukları ·
İmpotans ·
Gastroparezi ·
Diyare/konstipasyon ·
Yüzde kızarıklık ·
Ortostatik yakınmalar ·
Çarpıntı |
Bazen otonom disfonksiyon fokal
ve sınırlı bir etkilenmeye yol açar. Bunun örnekleri arasında en iyi bilineni
Horner sendromudur. Miyoz, ptoz (tarsal kas güçsüzlüğü) ve
anhidrozis klinik triadı ile karşımıza çıkar. Servikal sempatik disfonksiyon
sonucu oluşur. Esas patoloji pupilin karanlıkta büyüyememesi olduğundan iki
pupil arasındaki anizokori karanlıkta belirginleşir ve ışıkların kapatılmasıyla
küçük pupilin genişlemesindeki gecikme (dilatation tag) önemli bir diğer
klinik bulgudur. Horner sendromu, servikal sempatik liflerin merkezi ve periferik
seyri sırasında herhangi bir yerde etkilenmeleri sonucu oluşabilir. Servikal
sempatik sistem, 3 sıra nörondan oluşur. Bu nöronların ilki merkezi kontrol
bölgesi olan hipotalamustadır ve bu nöronların aksonları C8-T1 medulla spinalise
uzanır. İkinci sıra nöron, C8-T1 segmentlerinde intermediolateral hücre kolonunda
bulunur ve bu bölgeye Budge’ın siliospinal merkezi (ciliospinal center of
Budge) denilmektedir. Bu preganglionik nöronun aksonu, akciğer apeksinin
hemen üzerinden geçerek superior servikal ganglionda 3. sıra nöronu ile sinaps
yapar. Bu lokalizasyonda brakiyal pleksus alt trunkusu ile de yakın komşuluktadır.
Üçüncü sıra postganglionik nöronun aksonu karotis arter komşuluğunda kafa
içerisine girer, kavernöz sinüsten geçer ve orbitaya ulaşır. Anhidroz, karotis
bifurkasyonu distalinde bulunan lezyonlarda görülmez, bunun nedeni sudomotor
fonksiyonu kontrol eden sempatik liflerin bifurkasyon sonrasında eksternal
karotis arteri takip etmesidir. Ancak bazı hastalarda, alın bölgesinin terlemesini
kontrol eden sempatik lifler internal karotis arteri takip eder, bu nedenle
bu hastaların bir kısmında sadece alın bölgesinde anhidroz izlenebilir.
Horner sendromu nedenleri merkezi (1. sıra nöron ilişkili), preganglionik
(2. sıra nöron ilişkili) ve postganglionik (3. sıra nöron ilişkili) olmak
üzere sınıflandırılır (Tablo 7). Horner sendromunun tanısı
için çeşitli klinik testler kullanılabilir. Kokain damla testi ile Horner
sendromu tanısı konulur. %10’luk kokain solüsyonu her iki göze damlatılır.
Kokain norepinefrinin presinaptik geri alınımını inhibe eder ve ortamda
norepinefrin varlığında pupilin dilate olmasına neden olur. Pupil dilate
olmazsa Horner sendromu tanısı konulur. %1’lik hidroksiamfetamin hidrobromid
(Paredrin) solüsyonu, Horner sendromunun postganglionik nöron kaynaklı olup
olmadığını ayırt eder. Hidroksiamfetamin hidrobromid, sinaptik aralığa norepinefrin
salınmasını sağlar. Paredrin damla ile pupilde dilatasyon olmazsa, Horner
sendromunun nedeni postganglionik nörondur. Eğer pupil dilate olursa postganglionik
nöron sağlam demektir, bu durumda patoloji 1. veya 2. sıra nörondadır. Ancak
1 ve 2. sıra nöron ilişkili patolojileri birbirinden ayırt edebilecek bir
test bulunmamaktadır. Paredrin damla testi, kokain uygulamasından en az 48
saat sonra yapılmalıdır. Son yıllarda kokain damlası yerine temini daha kolay
olan, %0,5-1’lik aproklonidin damla testi kullanılmaktadır. Aproklonidin güçlü
bir α reseptör agonistidir ve zayıf α1 etkisi vardır. Bu nedenle normal sempatik
innervasyonu olan pupilde herhangi bir etkide bulunmaz. Horner sendromunda
ise, denervasyonla ilişkili adrenerjik hipersensitiviteye bağlı olarak pupil
dilate olur. Her iki göze damlatıldığı durumda anizokori tersine döner ve
miyozun olduğu göz midriyatik gibi gözükür.
Tablo 7. Horner sendromu nedenleri (Kaynak 2 ve 3’ten
değiştirilerek)
|
Merkezi nedenler (1. sıra nöron
ilişkili) ·
İskemik serebrovasküler hastalık
(lateral medüller sendrom-Wallenberg sendromu) ·
Tümör (hipotalamus, 3. ventrikül,
beyinsapı veya servikal spinal) ·
Demiyelinizasyon ·
İnflamasyon (örn., sarkoidoz) ·
Sirengomiyeli ·
Beyinsapı ensefaliti (enfeksiyöz-sfiliz
veya nonenfeksiyöz) |
|
Preganglionik (2. sıra nöron ilişkili) ·
Akciğer apeks tümörü (Pancoast
tümörü) ·
Boyun, brakiyal pleksus ve akciğer
travma ve cerrahisi sonrası ·
Mediastin veya boyunda lenfadenopati ·
Doğumsal brakiyal pleksus travması
(Klumpke paralizisi) ·
Torasik aort anevrizması ·
Neoplazmlar (tiroid, glomus tümörü,
nörofibrom, schwannom) |
|
Postganglionik (3. sıra nöron ilişkili)-
anhidroz eşlik etmez ya da alın bölgesi ile sınırlıdır ·
Karotis arter diseksiyonu ·
Kavernöz sinüs ilişkili patolojiler
(tromboz, infeksiyon, inflamasyon- sarkoidoz veya Tolosa-Hunt sendromu,
anevrizma) ·
Otonom sefaljiler (Küme başağrısı,
hemikranya kontinua) ·
Neoplazm veya travma (kavernöz
sinüs, orbita kaynaklı) |
Diğer bir sınırlı sendrom, yüzün
vazomotor ve sudomotor sempatik disfonksiyonu ile seyreden Harlequin
sendromudur. Stres, egzersiz veya ani emosyonel değişim ile birlikte
denervasyonun olduğu yüz tarafının soluk ve kuru olmasına sebep olur ve
bu da sendroma ismini veren yüz görünümüdür.
Pupilin parasempatik disfonksiyonu
sonucunda tonik pupil gelişir, bu durum silier ganglionun
veya silier sinirlerin etkilenmesi sonucu olabilir. Sıklıkla travmaya sekonderdir.
Başlangıçta izole internal oftalmopleji gelişir, pupil fikse dilatedir ve
akomodasyon bozuktur. Zaman içerisinde ışık cevabının olmadığı ancak yavaş
ve uzamış bir akomodasyon yanıtının olduğu midriyatik pupil izlenir, bu duruma
ışık-yakın disosiasyonu (light-near dissociation) denilmektedir. Travma
dışında tamamen sağlıklı 20-40 yaş kadın hastalarda unilateral veya bilateral
olarak görülebilir ve Adie’nin tonik pupil sendromu olarak
adlandırılır. Bu sendroma patella ve aşil tendon reflekslerinde kayıp da
eklenirse Holmes-Adie sendromu olarak bilinir. Tonik pupil,
hiporefleksi ve progresif segmental hipohidrozis ise Ross sendromu
olarak tanımlanmıştır. Sicca sendromu ise, ağız ve göz kuruluğu
ile seyreden, sıklıkla Sjögren hastalığı ile birlikte görülen otoimmün bir
lokalize otonomik disfonksiyondur. Yine lokalize bir sendrom olan primer
terleme bozukluklarından ise ilerleyen kısımlarda bahsedilecektir.
Eğer karşımızda jeneralize bir
otonom disfonksiyon tablosu varsa hangi sistemin öncelikle etkilendiğinin
tespit edilmesi ayırıcı tanıya gitmekte faydalı olacaktır. Parasempatik,
sempatik ve enterik otonom disfonksiyonda görülebilen bulgular Tablo 8’de özetlenmiştir.
Tablo 8.Otonom disfonksiyonda görülen klinik
bulguların alt gruplara ayrılması (Kaynak 3’ten değiştirilerek)
|
Sempatik otonom sinir sistemi |
|
|
Yetmezlik bulguları ·
Ortostatik hipotansiyon ·
Yaygın anhidroz (sıcak intoleransı) |
Otonom hiperaktivite bulguları ·
Taşikardi ·
Hipertansiyon ·
Hiperhidrozis |
|
Parasempatik otonom sinir sistemi |
|
|
Yetmezlik bulguları ·
Ağız ve göz kuruluğu ·
Pupil ışık cevabının azalması ·
Bulanık görme ·
Kalp hızı değişkenliğinin azalması ·
Üriner retansiyon ·
Cinsel bozukluk |
Otonom hiperaktivite bulguları ·
Lakrimasyon ve salyada aşırı
artış ·
Bradikardi ·
İdrara yetişememe |
|
Enterik otonom sinir sistemi |
|
|
Yetmezlik bulguları ·
Anoreksi ·
Erken doygunluk hissi, şişkinlik ·
Kusma, ishal ·
Hazımsızlık, kabızlık |
Otonom hiperaktivite bulguları ·
Abdominal kramp ·
Diyare |
Bir hastanın otonom semptomları
akut veya subakut olarak yerleştiyse düşünülmesi gereken sendromlar arasında
iskemik veya hemorajik serebrovasküler hastalık, Guillain-Barré sendromu,
akut otoimmün ganglionopati, paraneoplastik otonomik nöropati veya toksik
ajanlarla ilişkili nöropati bulunur. Kronik seyirli ve progresif gidişli
bir sendrom varsa o zaman dejeneratif sendromlar ile birlikte seyreden otonom
disfonksiyon (örneğin, parkinsonizm sendromları), amiloidoz ile ilişkili
otonom disfonksiyon veya herediter saf otonom disfonksiyon ile giden hastalıklar
akla gelmelidir.
Otonom disfonksiyon ile seyreden
tablolar merkezi ve periferik sinir sistemi kökenli hastalıklardan kaynaklanabilir
(Tablo 9). İzole otonom tutulum ile seyredebilecekleri gibi
sistemik veya nörolojik bir sendromun parçası olarak da izlenebilirler. Nörolojik
muayene bulguları özellikle önem taşımaktadır. Parkinsonizm bulguları varlığında
idyopatik Parkinson hastalığı, multi sistem atrofi; parkinsonizm ve demans
eşliğinde Lewy cisimcikli demans düşünülmelidir. Eğer polinöropati sendromu
eşlik ediyorsa akut yerleşimli hastalarda Guillain-Barré sendromu ve porfiri
akla gelirken, subakut-kronik seyirli sendromlarda diyabet, amiloidoz, üremi,
toksik nedenli nöropatiler (alkol veya kemoterapi ilaçları), enfeksiyon (lepra,
HIV), paraneoplastik nöropatiler ayırıcı tanı listesine girmektedir.
Tablo 9. Merkezi ve periferik sinir sistemi
kökenli otonom disfonksiyon ile giden hastalıklar (Kaynak
1 ve 2’den değiştirilerek)
|
Merkezi sinir sistemi kaynaklı
otonom disfonksiyon ile giden hastalıklar ·
Serebrovasküler hastalıklar ·
Multi sistem atrofi ·
Lewy cisimcikli demans ·
Parkinson hastalığı ·
Miyelopati-üriner disfonksiyon |
|
Periferik otonom disfonksiyon ile
giden hastalıklar ·
Ailevi disotonomi (HSAN III-
Riley Day sendromu) ·
Baroreseptör yetmezliği ·
Saf otonom yetmezlik ·
Akut otoimmün otonomik ganglionopati
(ganglionik nikotinik AChR antikorları ile ilişkili) ·
Periferik nöropati ile birlikte
otonom disfonksiyon -Diyabet -İmmün aracılı (Guillain-Barré
sendromu) -Metabolik (üremi) -Toksik -Genetik (Fabry hastalığı, aTTR-amiloidoz) -Amiloidoz (monoklonal otoantikorlar
ile ilişkili) -Enfeksiyon (HIV, lepra) |
Yukarıda anlatılanların ışığında
otonom disfonksiyon ile gelen hastada ayrıntılı anamnez ve muayenenin sendromun
lokalizasyonundaki önemi anlaşılmaktadır. Bu sayede hastadan gereksiz tetkik
istemeden ayırıcı tanı listesinin daraltılması sağlanır ve doğru tanıya hızlı
bir şekilde ulaşılabilir. Hastanın ilk değerlendirilmesinden sonra kullanmakta
olduğu ilaçların sorgulanması oldukça önemlidir. Hastanın otonom disfonksiyon
yaptığı bilinen bir ilaç kullandığının tespiti, hekimi zahmetli bir ayırıcı
tanı yükünden kurtaracaktır. Bu grup içerisinde sayılabilecek ilaçlar serotonin
sendromuna yol açabilecek antidepresanlar, antikolinerjik etkisi olan ilaçlar,
sempatomimetik ilaçların kötüye kullanımı, alkol çekilme sendromu ve izole
ortostatik hipotansiyon durumunda antihipertansif ilaçlardır.
Otonom
Disfonksiyon Değerlendirilmesinde Kullanılan Laboratuvar Testleri
Otonom disfonksiyonu olduğu düşünülen
hastada yapılması gereken birinci basamak laboratuvar testleri hemogram,
sedimentasyon hızı, açlık kan şekeri, üre, kreatinin ve hafif zincir amiloidozu
araştırmak için serum ve idrar immünfiksasyon elektroforezidir. Eğer polinöropatinin
klinik bulguları eşlik ediyorsa EMG yapılmalıdır. Akut-subakut başlangıç
varsa paraneoplastik nöropatileri dışlamak amacıyla paraneoplastik otoantikorlar
araştırılmalıdır. Duysal ganglionopati, göz ve ağız kuruluğu varsa Sjögren
sendromu için anti-Ro/La antikorları taranmalıdır. Ağrılı bir sendrom varlığında
amiloidoz (herediter ve hafif zincir), HIV ve Fabry hastalığına yönelik olarak
genetik ve serolojik incelemeler yapılmalıdır. Merkezi sinir sistemi tutulumu
ile birlikte bir otonom disfonksiyon ile karşı karşıya olunan durumlarda,
lezyonun lokalize edildiği bölge (kranial veya medulla spinalis) görüntülenmelidir.
Lokalize bir otonom disfonksiyon varlığında ise benzer şekilde lokalizasyona
uygun görüntüleme tetkikleri yapılmalıdır. Deri, rektal mukoza veya abdomen
yağ dokusu biyopsisi ise amiloidoz tanısını koymak amacıyla, genetik ve immünfiksasyon
elektroforezi normal çıktığında ve klinik olarak yüksek şüphe halinde yapılabilir.
Yukarıda sayılan incelemelerin
yanında otonom disfonksiyonu tespit etmek, kantitatif olarak tutulum derecesini
belirlemek, erken evre otonom disfonksiyonu göstermek ve merkezi ve periferik
sinir sistemi kaynaklı otonom disfonksiyon ayırımı amacıyla çeşitli elektrofizyolojik testler yapılabilmektedir. Bu elektrofizyolojik
testlerin bir kısmı rutin EMG laboratuvarlarında yapılabilirken bir kısmi
özel cihaz gerektirir.
Sudomotor fonksiyonları
değerlendiren testler
Sempatik deri yanıtı
(SSR); hoş olmayan
bir uyarı ile tetiklenen cilt direncindeki değişimi ölçer. Kolinerjik postganglionik
sempatik lifler ile innerve edilen ter bezlerinin bir fonksiyonu olduğu
düşünülmektedir. Sempatik deri yanıtının elde edilebilmesi için hem merkezi
hem periferik otonom sinir sisteminin birlikte çalışıyor olması gereklidir,
bu nedenle ikisinin ayrımında kullanılamaz. Ancak üst ve alt ekstremitelerde
çeşitli bölgelerden yanıt kaydedilebilir ve uzunluğa bağımlı bir etkilenme
tespit edilebilir bu da polinöropati lehine değerlendirilir. Periferik nöropati
hastalarında duyarlılığı düşük olarak saptanmıştır. Teknik olarak standart
bir SSR, avuç içi ve ayak tabanından kaydedilir. Hoş olmayan uyarı için,
median veya tibial sinir üzerine elektriksel uyarı veya sesli uyarı kullanılır.
Kaydedilen bi- veya trifazik yanıtın amplitüd ve latansı ölçülür. Yanıt incelemeler
arasında habitüasyona uğrar. Kullanılan sempatomimetik ilaçlar, alkol, kafeinden
etkilenir (Şekil 3).
Termoregülatuar
terleme testi (TST); ısıtılan bir oda içerisinde hastanın
terleme cevabı, vücuduna sürülen bir işaretleyici ile kaydedilir. Oda sıcaklığı
43-46ºC’de tutulup hasta 30-40 dakika bekletilir. İşaretleyici terleme ile
kırmızı veya mor renk alır. Terleme paternine göre merkezi veya periferik
sinir sistemi kaynaklı sempatik disfonksiyon ayrımı yapılabilir. Örneğin,
eldiven-çorap tarzı distal anhidroz, periferik patolojileri gösterirken,
dermatomal anhidroz radiküler bir tutulumu gösterir. Hemianhidroz ise tek
taraflı beyinsapı tutulumu lehine değerlendirilir. Global anhidroz ise merkezi
sinir sistemi patolojileri veya ilaçlarla ilişkili sendromları akla getirir.
Kantitatif sudomotor
akson refleks testi; postganglionik aksonun elektriksel
veya kimyasal olarak uyarılması sonrasında ter bezlerindeki yanıtın kaydedilmesi
ile ölçülür. Özel ekipman ve deneyim gerektirir. Duyarlı ve kantitatif bir
test olmakla birlikte merkezi sinir sistemi patolojilerinin ayrımında kullanılamaz.
Kardiyovasküler
otonom fonksiyonları değerlendiren testler
Bu testler, hiperventilasyon ile
kalp hızı değişkenliği, Valsalva manevrasına veya ortostatizme karşı gelişen
kalp hızı ve kan basıncı cevabının incelenmesidir.
Vagus siniri, her bir kalp atımında
kalp hızının kontrolünü sağlar. Hiperventilasyonda ise, inspiryum ile vagal
aktivitede azalma taşikardiye, ekspiryumda ise tam tersi bradikardiye neden
olur. Baroreseptörler, arkus aorta, karotis sinüsleri, kalp atriumu ve vena
kava duvarlarında bulunan gerime duyarlı mekanoreseptörlerdir. Kan basıncındaki
değişimleri takip ederek 9. Ve 10. kranial sinir aracılığı ile beyinsapında
bulunan sempatik ve parasempatik kontrol merkezleri üzerinden baroreseptör
refleks yanıtı oluştururlar. Örneğin Valsalva manevrası veya ayakta kalma
ile meydana genel kalbe venöz dönüşün azalması baroreseptör refleks aracılığı
ile vagus inhibisyonuna ve sempatik aktivitede aktivasyona neden olur.
R-R interval değişkenliği; istirahat, hiperventilasyon veya
Valsalva manevrası sırasında, bir dakika boyunca kalp ritminin kaydedilmesi
ile hesaplanır. Ayrıca uzun süreli olarak ritim holter cihazları kullanılarak
da yapılabilir. R-R değişkenliğinin yaşa göre normal değerlerin altında olması
parasempatik disfonksiyonu gösterir (Resim 3).
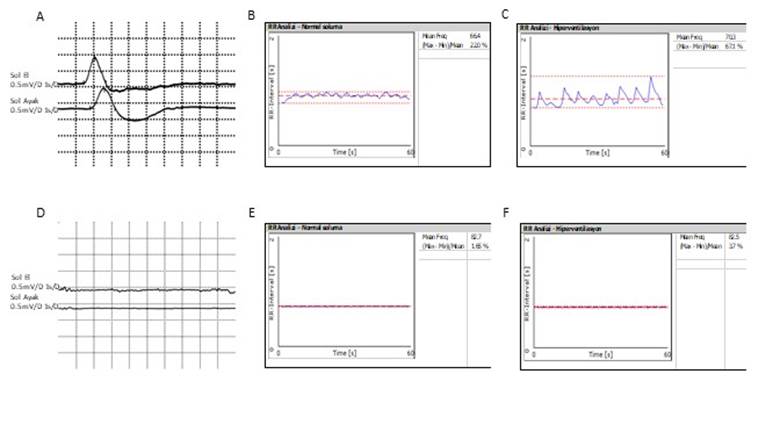
Şekil
3.
Örneklerde üst sırada sağlıklı bir kişide, alt sırada ise otonom fonksiyon
bozukluğu olan transtiretin ailesel amiloid polinöropatisi (TTR-FAP) tanılı
bir hastada otonom testler izlenmektedir. Şekil A’da sağlıklı kişide üst
(üstteki trase) ve alt (alttaki trase)ekstremitelerde normal sempatik deri
yanıtları izlenirken TTR-FAP hastasında sempatik deri yanıtlarının kaydedilemediği
görülmektedir (Şekil D). Şekil B ve C’de ise normal soluma (B) ve hiperventilasyon
(C) sırasında R-R değişkenlik analizi izlenmektedir. TTR-FAP hastasında hem
normal soluma hem de hiperventilasyon ile R-R değişkenliğinin belirgin derecede
azaldığı dikkati çekmektedir (Şekil E-F).
Ortostatik test;
kolay uygulanabilir
yatak başı testlerden birisidir (Şekil 4). Sağlıklı bireyde
fizyolojik koşullarda, ayağa kalkmakla birlikte kan basıncında düşme ve kalp
hızında artma izlenecektir. Belirli bir süre ayakta bekletildikten sonra
kan basıncında beklenenden fazla düşüş ve/veya kalp hızında beklenenden fazla
artış anormal olarak kabul edilir. Üç dakika ayakta bekletildikten sonra
sistolik kan basıncında 30 mmHg ve/veya diastolik kan basıncında 10 mmHg’dan
fazla düşüş olması nörojenik ortostatik hipotansiyon tanısını
koyduracaktır. Bu hastalarda tipik olarak kalp hızı artışı olmaz ancak bazı
hastalarda kalp hızında artış izlenebilir. Eğer kan basıncında düşme olmaksızın
kalp hızında dakikadan 30 atımdan fazla artış oluyor ve/veya ayakta iken
kalp hızı dakikada 120 atımın üzerine çıkıyorsa bu duruma postüral
taşikardi sendromu denilmektedir. Bir diğer patern ise refleks senkop
(vazovagal senkop)’tur. Refleks senkopta başlangıçta normal olan kan basıncı
ve kalp hızı sonrasında ani bir düşüş gösterir. Bu testler tilt-table kullanılarak
baş 70-90º yükseltilecek şekilde, daha duyarlı olarak yapılabilmektedir.
Valsalva manevrasını takiben kan
basıncında izlenen değişimin ölçülmesi diğer bir testtir. Bu testte her bir
kalp tepe atımında (beat-to-beat) kan basıncı takibi yapılır. Valsalva manevrası
sonrası fizyolojik bir yanıt elde edilir. Bu yanıtın ilk aşaması, torasik
ve intraabdominal basınç artışına bağlı yaklaşık 3-4 saniye süren kan basıncında
yükselme ve buna ikincil gelişen bradikardidir. Yanıtın ikinci fazı erken
ve geç olmak üzere iki kısımdan oluşur. İkinci fazın erken kısmında venöz
dönüş azalmasına bağlı kan basıncında düşme ve buna ikincil baroreseptör
refleks aracılığı ile gelişen taşikardi olur. İkinci fazın geç kısmında sempatik
aktivite artışına bağlı gelişen kan basıncında normale dönme izlenir. Yanıtın
üçüncü fazında mekanik gerilmenin sonlanmasına bağlı gelişen ilk yanıta benzer
ancak ters bir yanıt görülür. Dördüncü fazda, venöz dönüşün normale dönmesi
ile kan basıncında artış ve refleks bradikardi izlenir. Bu yanıt içerisinde
ikinci fazın geç kısmının izlenmemesi adrenerjik yetmezlik ile ilişkilidir
(Şekil 4).
Bu testlerin haricinde ürodinamik
incelemeler ile postmiksiyonel rezidü tespit edilebilir ve nörojenik mesane
olasılığı değerlendirilebilir. Gastrointestinal motilite incelemeleri de
enterik otonom sinir sisteminin fonksiyonlarını değerlendirebilmektedir.
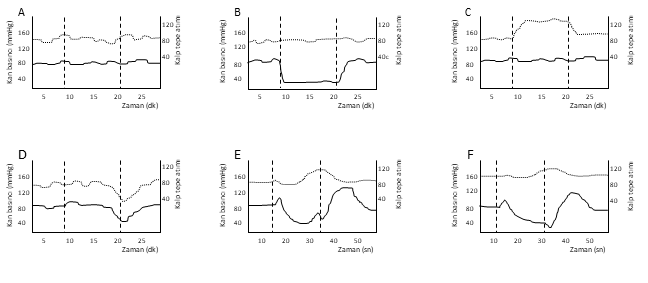
Şekil
4.
Her kalp atımında kan basıncı ve nabız analizi. Yatay düz trase kan basıncını,
yatay kesikli trase ise kalp tepe atımı değerlerini göstermektedir. Şekil
4 A-D’de ortostatik yanıtlar izlenmektedir. Dikey kesikli çizgiler arasında
ayağa kalkma dönemi gösterilmiştir. Şekil A’da normal kişide izlenen yanıtlar
görülmektedir. Şekil B’de ise nörojenik ortostatik hipotansiyon yanıtı izlenmektedir,
burada ayağa kalkmakla birlikte kan basıncında düşme izlenmektedir. Şekil
C’de, postural ortostatik taşikardi sendromu örneği görülmektedir, ayağa
kalkmakla birlikte kalp tepe atımında hızlanma görülür. Şekil D’de belirli
bir süre ayakta kaldıktan sonra gelişen kan basıncında düşme dikkati çekmektedir
ve bu durum refleks senkop ile uyumludur. Refleks senkopta, kan basıncı ve
kalp tepe atımının ayağa kalkınca erken dönemde normal olduğuna ve belirli
bir süre sonra ani düşüş gösterdiğine dikkat ediniz. Şekil E-F’de Valsalva
manevrasına karşın izlenen kan basıncı ve kalp tepe atım değişikliği görülmektedir.
Burada dikey kesikli çizgiler Valsalva manevrasını göstermektedir. Şekil E’de
normal bir yanıt, şekil F’de ise adrenerjik yetmezlik durumundaki yanıt izlenmektedir.
Faz 2’nin geç kısmında izlenmesi gereken kan basıncındaki artışın yokluğu
şekil F’de görülmektedir. (Kaynak
1’den şematize edilerek alınmıştır)
OTONOM DİSFONKSİYON
İLE GİDEN HASTALIKLAR
Nörojenik Ortostatik
Hipotansiyon
Üç dakika ayakta bekletildikten
sonra sistolik kan basıncında 30 mmHg ve/veya diastolik kan basıncında 10
mmHg’dan fazla düşüş olması nörojenik ortostatik hipotansiyon olarak adlandırılır.
Semptomatik veya asemptomatik olabilir. Semptomlar başta hafiflik hissi,
fenalık hissi, göz kararması, halsizlik, yorgunluk, baş, ense ve omuzlarda
ağrı (boyun ve baş bölgesindeki kasların iskemisine bağlı) şeklindedir. Ortostatik
hipotansiyon sonrasında senkop da izlenebilir. Nörojenik ortostatik hipotansiyonun
nedeni, sempatik vazokonstriktör etkinin bozulmasıdır. Bu hastalar yemeklerden
yaklaşık 30 dakika-2 saat sonra postprandial hipotansiyon da yaşayabilirler.
Semptomlar sıcak havada, uzun ayakta kalma, aşırı egzersiz ile de tetiklenebilir.
Bazı hastalarda, ortostatik hipotansiyon 3 dakikadan sonra görülebilir, bu
durumda gecikmiş ortostatik hipotansiyondan bahsedilir. Bu nedenle şüphelenilen
hastalarda test süresi 5 dakikaya uzatılmalıdır. Yerçekiminin etkisi ile azalan
venöz dönüş, kardiyak çıktıyı azaltacak ve buna sekonder baroreseptör aracılı
sempatik aktivitede artış meydana gelecektir. Bu durum periferik vasküler
direnci, kardiyak çıktıyı arttırarak kan basıncını stabil tutacaktır. Bu
mekanizmanın (baroreseptör aracılı sempatik vazokonstriksiyon) bozulması nörojenik
ortostatik hipotansiyonun patofizyolojisini oluşturmaktadır. Baroreseptör
aracılı sempatik aktivitenin olmaması nedeniyle kalp hızı artışı beklenmez.
Ancak bir grup hastada olabilir. Ortostatik hipotansiyon ile gelen hastalarda
en sık neden özellikle yaşlı hastalarda yetersiz sıvı ve sodyum alımı ve antihipertansif
ilaçlardır. Bu nedenler elendiğinde, yukarıda bahsedilen merkezi ve periferik
sinir sistemi kaynaklı otonom disfonksiyon ile giden hastalıkların çoğu nörojenik
ortostatik hipotansiyon nedenidir. Ortostatik hipotansiyonun tedavisinde
yatar pozisyondan ayağa kademeli olarak kalkılması, su ve tuz tüketiminin
arttırılması gibi nonfarmakolojik önerilerin yanında semptomların şiddetine
göre bir sempatomimetik olan midodrin ve fludrokortizon asetat tedavisi kullanılabilir.
Postüral Taşikardi
Sendromu (POST)
POST, ortostatik intoleransın sık
izlenen klinik tablolarından biridir. On dakika ayakta durmayı takiben, kan
basıncında düşme olmadan kalp tepe atımının dakikada 30 ve üzeri artması veya
dakikada 120’nin üzerinde olması şeklinde tanımlanır. Klinik semptomlar ayağa
kalkmakla ortaya çıkan ortostatik hipotansiyona benzer şekilde başta hafiflik
hissi, gözlerde kararma, halsizlik, çarpıntı, göğüs ağrısıdır. Semptomlar
oturma ile azalır ve kaybolur. POST’un birkaç alt grubu bulunur. Bunlardan
nörojenik POST’da patofizyolojik mekanizma, ortostatizme sekonder gelişmesi
beklenen alt ekstremitelerde sempatik vazokonstriktör cevabın bozulmasıdır.
Valsalva manevrası sırasında yapılan testte her bir kalp atımı ile ölçülen
kan basıncı cevabının ikinci fazının gecikmiş kısmındaki adrenerjik yanıt
azalmış olarak kaydedilir. Hiperadrenerjik POST da ise aşırı kardiyak sempatik
aktivite görülür ve bu hastalarda sadece ayağa kalkmakla değil stres ve egzersiz
ile de semptomlar ortaya çıkabilir. Valsalva testinde, ikinci fazın gecikmiş
kısmında aşırı bir adrenerjik yanıt izlenir. Hiperadrenerjik POST, Morvan
sendromu gibi immünolojik kökenli ensefalit sendromlarında görülebilir. Bunların
haricinde hipovolemi veya hemoglobin düşüklüğüne bağlı da POST izlenebilir.
POST tedavisinde nonfarmakolojik yaklaşım ortostatizm ile ilişkili önlemlerin
alınması, su ve tuz alımının arttırılmasından oluşur. Medikal tedavi olarak
fludrokortizon, midodrin ve beta blokerler kullanılabilir.
Baroreseptör Yetmezliği
Baroreseptör refleksi, kan basıncındaki
dalgalanmaları önlemek amacıyla çalışan bir reflekstir. Yetmezliğinde ise
kardiyovasküler bulgular ortaya çıkar. Bu bulgular akut hipertansiyon, dalgalanan
hipertansiyon, ortostatik taşikardi ve ciddi bradikardidir. Bilateral karotis
arter cerrahisi geçirmiş, boynuna radyoterapi alan hastalarda, Guillain-Barré
sendromunda, ailevi disotonomide veya nukleus traktus solitariusu etkileyen
beyinsapı tutulumlarında gelişebilir. Vazoaktif ilaçlara karşı aşırı duyarlılık
olması ve labil hipertansiyon diğer efferent otonom disfonksiyon sendromlarından
baroreseptör yetmezliğini ayırıcı özelliklerdir. Valsalva manevrası ile kan
basıncı değişkenlik testinde faz 2 ve 4 yanıtı azalmış olarak kaydedilir.
Refleks Senkop
Refleks senkop; vazovagal (emosyonel veya ortostatik),
postmiksiyon, postegzersiz, gastrointestinal stimülasyon sonrası, Valsalva
manevrası sonrası gibi durumla ilişkili senkoplar veya karotis sinüs senkobu
olarak alt gruplara ayrılır. Refleks senkoptaki temel mekanizma anormal tetikleyici
ile ortaya çıkan vagal aktivasyonda artma ve/veya sempatik aktivasyonda azalmaya
bağlı kardiyak çıktıda meydana gelen ani azalmadır. İki temel klinik özelliği
bulunur; birincisi senkop öncesinde solukluk, terleme, bulantı gibi otonom
bulguların görülmesi ve ikincisi de mutlaka bir tetikleyici ile oluşmasıdır.
Vazovagal senkop, 13-16 yaşlarında başlar ve ayakta durma,
ağrı veya stres ile tetiklenir. Nörojenik ortostatik hipotansiyona bağlı
senkop ile vazovagal senkop farklı durumlardır. Nörojenik ortostatik hipotansiyondaki
temel mekanizma sempatik otonom cevabın yetersizliğidir. Oysaki vazovagal
senkopta temel mekanizma, anormal stres, emosyon veya ortostatik stres sonucu
oluşan vagal aktivasyonda artma ile oluşan kardiyak çıktıda azalmadır. Karotis
sinüs senkobu, karotis baroreseptör aşırı duyarlılığı veya glossofaringeal
nevralji sonrasında gelişebilir. Karotis baroreseptörünün uygunsuz aktivasyonu
ile meydana gelir. Tıraş olurken, gömleğin yakasını iliklerken veya kravat
bağlarken tetiklenebilir. Refleks senkobun ayırıcı tanısında kardiyak kökenli
(aritmi veya kardiyomiyopati) senkoplar ve epileptik nöbetler unutulmamalıdır.
Tüm senkop hastaları kardiyak açıdan ayrıntılı olarak araştırılmalıdır.
Senkoplar kısa süreli bilinç kaybı ile karakterize ataklar olduğundan epileptik
nöbetlerden de ayrılmalıdırlar (Tablo 10).
Tablo 10. Senkop ve epileptik nöbet ayırıcı
tanısında kullanılabilecek klinik özellikler (Kaynak 4’ten değiştirilerek)
|
|
Senkop |
Epileptik nöbet |
|
Tetikleyici |
·
Ayakta durma ·
Emosyon (ağrı, korku vb.) ·
Miksiyon ·
Gastrointestinal stimülasyon ·
Egzersiz ·
Kravat takma, tıraş olma, sıkı
yaka |
·
Uykusuzluk ·
Açlık ·
Işık uyaran ·
Sıcak su ·
Hiperventilasyon ·
Okuma |
|
Aura |
·
Başta hafiflik hissi ·
Göz kararması ·
Solukluk ·
Bulantı ·
Terleme ·
Kulakta uğultu |
·
Mideden yükselen his ·
Dejavu, jamais-vu hissi ·
Jaksonian yayılım gösteren paresteziler ·
Başta anormal duyumsama ·
Afazi ·
Koku veya tat hisleri ·
Görsel semptomlar |
|
İktal özellikler |
·
Kas tonusu gevşektir* ·
Renk soluktur ·
Dil ısırması nadirdir varsa dilin
ucundadır ·
İdrar inkontinansı nadirdir ·
Hipotansiyon ve bradikardi |
·
Kas tonusu artmıştır (atonik nöbetler
dışında) ·
Tonik-klonik kasılma izlenebilir ·
Otomatizmalar görülür ·
Dilin yan tarafı ısırılır ·
Renk siyanozedir (özellikle jeneralize
konvülziyonda) |
|
Postiktal |
·
Kısa süre içerisinde tamamen kendine
gelir |
·
Dakikalar içerisinde ·
Postiktal konfüzyon veya fokal
nörolojik defisit (örneğin, Todd parezisi) görülebilir |
|
Yaralanma |
·
Nadir ·
Varsa da klinik olarak önemsiz
|
·
Jeneralize nöbetlerde özellikle
sık ·
Omuz çıkması şeklinde olabilir |
*Konvülzif senkopta,
kısa süreli tonik ve klonik atımlar olabilir.
Terleme Bozuklukları
Terleme, sempatik kolinerjik sistem
ile kontrol edilen önemli bir termoregülatuar fonksiyondur. Bozuklukları
hiper veya anhidrozis olarak isimlendirilir. Fokal veya jeneralize olabilirler.
Yaygın otonom disfonksiyon yapan hastalıklar ile birlikte olabilecekleri
gibi idyopatik olarak da karşımıza çıkabilirler. Örneğin distal ekstremiteleri
tutan anhidroz distal polinöropatiler ile birlikte görülürken jeneralize
anhidroz, multisistem atrofi gibi merkezi sinir sistemi kaynaklı otonom disfonksiyon
yapan hastalıklarda görülebilir. İpsilateral anhidroz, beyinsapı veya servikal
omurilik lezyonlarında izlenir. Segmental hipohidroz, Ross sendromunda tonik
pupil ile birlikte görülür. Diğer segmenter hipo/anhidroz nedenleri, ganglionopatiler
ve miyelopatilerdir. Fokal veya multifokal anhidroz, mononöropatiler, mononöropati
mültipleks ve leprada görülebilir. Hiperhidroz ise, Morvan hastalığı, fatal
ailesel insonmi (prion hastalığı), alkol çekilme sendromu, intoksikasyon,
nöroleptik malign sendrom, metabolik nedenler (tirotoksikoz, hipoglisemi,
feokromasitoma) kaynaklı olabilir. Hipo- veya hiperhidroz nedenleri arasında
ilaçlar ilk akla gelmesi gereken nedenlerdir. Fokal idyopatik hiperhidrozis,
aksilla, avuç veya yüz bölgesini etkileyebilir ve sosyal olarak kısıtlayıcı
olabilir. Böyle durumlarda botulinum toksini enjeksiyonu, dermiste ter bezlerinin
ekzisyonu veya ilişkili sempatik ganglionların eksizyonu (torasik zincir
sempatektomisi) yapılabilir.
Otonom disfonksiyon
ile giden nörodejeneratif hastalıklar
İntraselüler α-sinüklein birikimi
ile giden nörodejeneratif hastalıklarda değişik derecelerde otonom disfonksiyon
görülür. Bu hastalıklar içerisinde multisistem atrofi, Parkinson hastalığı,
Lewy cisimcikli demans, saf otonom yetmezlik bulunur. Klinik olarak ortostatik
hipotansiyon, nörojenik mesane, gastrointestinal sistem motilite bozuklukları
ve impotans en sık görülen bulgulardır. (Bu hastalıklar için bakınız: ‘Sinir
Sisteminin Dejeneratif Hastalıkları’). Burada saf otonom yetmezlikten bahsedilecektir.
Saf otonom yetmezlik, 50-70 yaşında başlayan ortostatik hipotansiyon, gastrointestinal
sistem, mesane ve cinsel fonksiyon bozukluğu ile karakterize yavaş progresif
bir dejeneratif bir hastalıktır. Hastalarda motor fonksiyon bozukluğu,
kognitif veya duysal yakınmalar, serebellar veya ekstrapiramidal bulgular
bulunmaz. Ancak bir kısım hastada, 5 yıllık takip süresince bu bulgular
klinik tabloya eklenebilir ve o zaman hastalık ilgili sendroma değişir.
Patolojik olarak, otonom ganglionlarda α-sinüklein birikimi izlenir.
Otonom Disfonksiyon
ile Giden Nöropatiler (Ayrıca bakınız: ‘Periferik sinirlerin
yaygın ve çok odaklı hastalıkları’)
Otonom disfonksiyon ve nöropati
birlikteliği olan hastalıklarda klinik tablo sıklıkla ağrılıdır. Bu grup
hastalıklar Tablo 11’de sıralanmıştır. Bunlardan amiloidoz, uzunluğa bağımlı duysal ve motor aksonal ağrılı bir
polinöropati ve yaygın otonom disfonksiyon yapar. Amiloidoz kazanılmış veya
herediter olabilir. Kazanılmış amiloidozun periferik nöropati ile birlikte
olan formu hafif zincir amiloidozdur (AL amiloidoz), herediter formu ise transtiretin
amiloidozdur. Kardiyak tutulumun da eşlik ettiği bu hastalık grubunda prognoz
kötüdür. Diyabetik otonom disfonksiyon, sıklıkla diyabetik
polinöropati ile birliktedir ve uzunluğa bağımlı duysal liflerin ön planda
etkilendiği ağrılı aksonal polinöropati yapar. Bu sendromların çoğu ağrılı
olmakla birlikte özellikle ince lif nöropatisi kliniğinin en belirgin olduğu,
ağrılı distal nöropati şeklinde seyreden hastalıklar herediter
duysal ve otonom nöropati (HSAN), Fabry hastalığı ve vaskülitlerdir.
Bu hastalıklarda klinik olarak ekstremite distallerinde ağrı ve yanma, batma
ve üşüme şeklinde paresteziler ön plandadır. HSAN III, otozomal resesif geçişli
konjenital veya infantil başlangıçlı izole otonom disfonksiyon ile giden
bir hastalıktır. Klinik bulgular, gözyaşının olmaması, azalmış patella refleksi,
dilde fungiform papilla yokluğu, kan basıncı düzensizliği, termoregülasyon
bozukluğu ve ekstremite distallerinde ağrı ve ısı duyusunun yokluğudur. Hastalarda
ağrı duyarsızlığı fark edilemeyen kırıkların olmasına neden olur. Ayrıca
göz kuruluğuna bağlı kornea ülserleri görmeyi olumsuz etkiler. Otoimmün kökenli
otonom disfonksiyon ile giden nöropatiler Guillain-Barré sendromu,
otoimmün otonomik ganglionopati, paraneoplastik otoimmün ganglionopati ve
Sjögren hastalığıdır. Otoimmün otonomik ganglionopati,
subakut yerleşimli ganglionik tip nikotinik ACh reseptörlerine karşı gelişen
otoantikorlar ile karakterize, jeneralize sempatik ve parasempatik otonom
disfonksiyon ile giden bir hastalıktır. Klinik olarak ortostatik hipotansiyon,
ağız ve göz kuruluğu, impotans, ve konstipasyon görülürken duysal ve motor
sinirlerde bozukluk izlenmez. İnfeksiyon veya cerrahi sonrası gelişebilir.
Tedavisinde immünsupresyon, IVIg veya plazmaferez kullanılır. Paraneoplastik
otonom ganglionopati, sıklıkla küçük hücreli akciğer kanseri ile birliktedir.
Paraneoplastik antikorlardan ANNA-1 (anti Hu) pozitifliği görülebilir ve
klinik olarak jeneralize bir otonom disfonksiyona neden olur.
Tablo 11. Otonom disfonksiyon ile birlikte
seyreden nöropatiler (Kaynak
1 ve 2’den değiştirilerek)
|
Akut-subakut seyirliler ·
Guillain-Barré sendromu ·
Otoimmün otonomik ganglionopati
(akut pandisotonomi) ·
Porfiri |
|
Kronik seyirliler ·
Diyabet ·
Amiloidoz ·
İmmün kökenliler -Sjögren sendromu -Paraneoplastik ·
İnfeksiyöz nedenliler -HIV -Lepra ·
Toksik nedenliler -Alkol -Kemoterapi ilaçları ·
Herediter -Herediter duysal ve otonom nöropatiler
(HSAN) -Ailevi disotonomi (HSAN III-Riley
Day Sendromu) -Transtiretin amiloid nöropati -Fabry hastalığı ·
İnflamatuar -Vaskülitler ·
İdyopatik |
Otonom Disfonksiyon
ile Giden Diğer Nörolojik Hastalıklar
Lambert-Eaton miyastenik
sendromu, nöromüsküler
kavşak ve otonom ganglionların presinaptik terminallerinde bulunan voltaj
kapılı kalsiyum kanallarına karşı gelişen otoantikorların sorumlu olduğu,
idyopatik veya paraneoplastik olarak karşımıza çıkan otoimmün bir hastalıktır.
Klinik olarak kas güçsüzlüğü, arefleksi ve otonom disfonksiyon ile hekime
gelir. Ağız kuruluğu, impotans ve ortostatik hipotansiyon bu sendromda
en sık görülen otonom disfonksiyon bulgularıdır. Otonom disfonksiyon yapan
bir başka nöromüsküler kavşak hastalığı da botulismustur.
Kontamine gıda yemeyi takiben 12-36 saat içerisinde gelişen desendan kas
güçsüzlüğü ile birlikte bulanık görme, pupil ışık cevabının azalması, midriazis,
ağız kuruluğu, kabızlık ve idrar retansiyonu gibi otonom bulgular ile karakterizedir
(Ayrıca bakınız: Kas ve nöromüsküler kavşak
hastalıkları).
Morvan sendromu, voltaj kapılı potasyum kanalına
(VGKC) karşı gelişen otoantikorlar ile ilişkili periferik sinir hipereksitabilitesi
(katılık, kramp, miyokimi, nöromiyotoni), limbik ensefalit, insomni ve otonom
disfonksiyon (hiperhidroz, salya ve gözyaşı artışı, taşikardi, üriner inkontinans,
konstipasyon) ile giden klinik bir tablodur. Morvan sendromunun haricinde
VGKC ve NMDA antikorları ile ilişkili limbik ensefalit tablolarında
da otonom disfonksiyon klinik tablonun bir parçasıdır. Temporal
nöbetler, otonom semiyoloji ile seyredebilirler. Ayrıca epilepsi hastalarında
izlenen beklenmedik ani ölümlerin (SUDEP)
etyolojisinde otonom disfonksiyon suçlanmaktadır. Hipotalamus ve beyinsapı
kaynaklı hastalıklar (yer kaplayıcı lezyonlar, vasküler malformasyonlar,
inflamatuar ve enfeksiyöz hastalıklar, serebrovasküler hastalıklar ve sirengobulbi)
merkezi sinir sistemi kaynaklı otonom disfonksiyona neden olabilirler. İnsulayı tutan iskemik veya hemorajik infarktlar, kardiyak aritmilere
veya miyokard hasarına neden olabilirler. Medulla spinalisi tutan
hastalıklar (multipl skleroz, nöromiyelitis optika, sirengomiyeli, yer
kaplayıcı lezyonlar, vasküler malformasyonlar, “stiff-person” sendromu,
herediter spastik paraparezi) başta mesane ve cinsel bozukluk olmak üzere
otonom disfonksiyon yaparlar. Servikal ve üst torakal omurilik
yaralanmalarında ortostatik hipotansiyon, gastrointestinal sistem motilite
bozuklukları, mesane ve cinsel fonksiyon bozuklukları, termoregülasyon bozuklukları
gözükebilir. Bu grup hastalarda otonom disrefleksi adı verilen
viseral veya somatik uyaran ile tetiklenen hipertansiyon, bradikardi atakları,
kardiyak aritmi ve aşırı terleme ile seyreden ve hayatı tehdit edebilen bir
sendrom gelişebilir. Bu durum sempatik preganglionik nöronlara üst yapılardan
gelen kontrolün kaybı nedeniyle gerçekleşir. Trigeminal otonomik
sefaljilerde ise, ağrıya eşlik eden otonom hiperaktivite izlenir (Ayrıca
bakınız: Başağrısı).
Kompleks Bölgesel
Ağrı Sendromu
Kompleks bölgesel ağrı sendromu
(KBAS); duysal, motor, vazomotor, sudomotor veya trofik özellikler ile seyreden
bir periferik nöropatik ağrı sendromudur. Bazen başlatıcı bir olay sonrası
gelişir. Bu olay travma, kırık, ekstremitenin hareketsiz kalması veya periferik
sinir zedelenmesi olabilir. Tek bir ekstremitede devamlı ağrı başlar. Bu
ağrının şiddeti, başlatıcı olayın şiddetinden çok fazladır. Ağrının bulunduğu
bölgede duysal (parestezi, allodini), vazomotor (ısı artışı, ciltte kızarıklık),
sudomotor (ödem), motor (hareketsizlik, güçsüzlük, atrofi) veya trofik (tırnak
ve kıl değişiklikleri) bulgulardan en az üçü eşlik etmelidir. Tanı için bu
bulgulardan en az biri muayene ile gösterilmelidir. İki tipe ayrılır; CBAS-1’de
cerrahi, kırık, travma başlatıcı olayken CBAS-2’de periferik sinir hasarı
tabloya eşlik eder ve buna kozalji denilmektedir. Klinik seyirde
öncelikle ekstremite aşırı derecede ağrılı, şiş, kızarık olurken hastalık
ilerledikçe kas güçsüzlüğü ve atrofi gelişerek işlev kaybına neden olur.
Hastalığın patolofizyolojisi bilinmemekle birlikte inflamasyon, vazomotor
disfonksiyon, kütanöz innervasyonda ve merkezi sinir sistemi organizasyonunda
değişiklik altta yatan mekanizmalar olarak suçlanmıştır. KBAS tanısı klinik
muayene ile konur. EMG, eşlik eden periferik sinir hasarını tespit etmek
için kullanılabilir. Tedavisinde rehabilitasyon ve fizik tedavi teknikleri
kullanılmaktadır. Ardışık transkranial manyetik sinir uyarımı teknikleri
ve IVIg tedavilerinin kullanımı vaka bildirileri şeklindedir.
Kaynaklar:
1)
Benarroch
E. Autonomic Neurology, Oxford University Press, NewYork, 2014.
2)
Daroff
RB, Jankovic J, Mazziotta JC, Pomeroy SL. Bradley’s Neurology in Clinical
Practice. Elsevier, 7nd edition, London, 2016.
3)
Brazis
PW, Masdeu JC, Biller J. Localization in Clinical Neurology. Lippincott Williams
and Wilkins, Philadelphia, 2011.
4)
Bebek,
N. Nörolojide Ayırıcı Tanı. O’Tıp Kitabevi, İzmir, 2017.
5)
Lauria
G, Merkies IS, Faber CG. Small fibre neuropathy. Curr Opin Neurol 2012;25(5):542–549.