METABOLİK ENSEFALOPATİ
Yazanlar: Candan Gürses, Ayşen
Gökyiğit
Son Güncelleştirme Tarihi: 15.05.2019
Metabolik ensefalopatiler, sistemik stres indüksiyonu ile birlikte
serebral ödem, transmitter fonksiyonlarındaki değişiklikler, toksik madde birikimi
ve enerji kaybı ile giden fokal veya global serebral
fonksiyon bozukluklarıdır. Klinik olarak bakıldığında nöropsikolojik testler
ile ortaya konabilen ılımlı mental değişikliklerden derin komaya kadar uzanan
tablolar görülür. Etiyolojiden metabolik (en çok hepatik ve renal kaynaklı)
nedenler sorumludur. Beyinde bilinç durumundan sorumlu olan bölgeler; asendan
retiküler aktive edici sistem (ARAS) ve serebral kortekstir. Metabolik
ensefalopatilerde buraların etkilenmesi ile selektif dikkat eksikliği ve
bilginin değerlendirilmesinde
bozulma olur. Buna bağlı olarak başlıca oryantasyon
bozukluğu, kognitif bulgular, afektif bozukluklar ve algı bozuklukları ortaya
çıkar.
Nörolojik ve nöro-oftalmolojik muayene
metabolik bozukluğu olan hastada son derece önemlidir. Hasta derin komada olsa
bile ışık refleksi ve vestibüler cevap korunmuştur. İstisnalar arasında ağır
hipoksi, yüksek miktarda atropin veya skopolamin alınmış olması, dolaşım
yetmezliği ve izoelektrik elektroensefalografi (EEG)nin
eşlik ettiği derin barbitürat koması vardır. Pupiller normale göre küçük ve bir
miktar düzensizdir. Hafif ensefalopatisi olanlarda ise göz muayenesi normal
olabilir. Daha ağır ensefalopatisi olanlarda konjuge olmayan göz hareketleri ve
nadir olmakla birlikte kranial sinir tutulumları olabilir.
Motor sistemde hafif düzeydeki tonus artışı en sık izlenen
bulgudur. Metabolik bozukluklarda görülen diğer bulgu ve semptomlar,
karaciğer hastalıklarında spastisite ile ekstansör plantar yanıt, üremik
hastalarda multifokal miyokloni, elektrolit bozukluklarında kramplar,
hipokalsemide Trousseau ve Chvostek belirtileridir.
Ayrıca tremor ve kuvvet kayıpları da görülebilir. Postüral tonusun kaybına
bağlı asteriksis (flapping tremor) olabilir. Bu bulgu, ellerin
ekstansiyona getirilmesi ile daha rahat izlenir. Dışarı çıkarılmış dilde, sımsıkı kapatılmış
göz kapaklarında, yüzükoyun pozisyonunda yatarken fleksiyona getirilmiş
dizlerde de asteriksis görülebilir.
Jeneralize nöbetler; su intoksikasyonları, hipoksi, üremi, hipokalsemi ve hipoglisemi,
nadir olarak da karaciğer yetmezliklerinde görülebilir. Fokal nöbetler, epilepsia
parsiyalis kontinua dahil olmak üzere
hiperglisemide izlenebilir. Multifokal miyoklonik nöbetler üremi,
hipoksik beyin hasarı geçirenlerde görülebilir.
HEPATİK ENSEFALOPATİ
Kronik karaciğer hastalığı olanlarda terminal dönemde ensefalopati
gelişmesi morbiditeyi ve mortaliteyi önemli ölçüde arttırır. Karaciğer
hastalığında iki mekanizma ensefalopati nedeni olabilir: hepatoselüler
yetmezlik ve hepatik venden sistemik dolaşıma geçen toksinler. Bir mekanizma
ensefalopati geliştirebileceği gibi, iki mekanizmanın değişik derecelerde etken
olduğu da gösterilmiştir.
Hepatik ensefalopati
(HE) tipi, süresi ve niteliklerine göre gruplara ve alt gruplara ayrılarak
sınıflandırılır (Tablo 1a).
Tablo 1a. Hepatik ensefalopati sınıflandırması
A- Akut karaciğer yetmezliğinin
yol açtığı HE
B- Portal sistemik
baypas ile oluşan (intrensek hepatoselüler hastalığın bulunmadığı) HE
C- Sirozun yol açtığı
(portal hipertansiyon veya portosistemik şantların eşlik ettiği) HE
Epizodik HE
Tetikleyici faktörlerle ortaya çıkan
Spontan olan
Devamlı kalıcı HE
Hafif
Ağır
Tedaviye bağımlı
Minimal HE*
HE: Hepatik ensefalopati
* Minimal HE, subklinik
HE yerine önerilen, HEnin belirgin klinik bulguları olmaksızın sadece
nöropsikolojik ve nörofizyolojik testlerle ortaya konabilen kognitif bozukluk
durumunu tanımlayan terimdir. Bu sınıflamada ayrı bir kategori olarak ele alınmıştır.
Fulminan hepatik
yetmezlik ve portal
sistemik ensefalopati; birbirinden farklı öykü ve klinik, laboratuvar
özellikleri olan karaciğer hastalıklarıdır.
Tablo 1b. Hepatik ensefalopati tiplerinin ayırt ettirici
özellikleri
|
|
Fulminan Hepatik Yetmezlik |
Portal Sistemik Ensefalopati |
|
ÖYKÜ |
|
|
|
Başlangıç |
Genellikle akut |
Sinsi, subakut |
|
Mental durum |
Duygudurum bozukluğundan-komaya
değişken |
Bilinç bulanıklığından-komaya
değişken |
|
Tetikleyen faktör |
Viral infeksiyonlar, toksinler |
Gastrointestinal kanama, ekzojen
protein alımı, ilaçlar, üremi |
|
Öyküde karaciğer hastalığı |
Yok |
Genellikle var |
|
SEMPTOMLAR |
|
|
|
Bulantı, kusma |
Sık |
Nadir |
|
Karın ağrısı |
Sık |
Nadir |
|
BULGULAR |
|
|
|
Karaciğer |
Küçük, yumuşak ve hassas |
Genellikle büyük, sert ve ağrısız |
|
Beslenme durumu |
Normal |
Kaşektik |
|
Kollateral dolaşım |
Yok |
Var |
|
Asit |
Yok |
Olabilir |
|
LABORATUVAR |
|
|
|
Transaminazlar |
Çok yüksek |
Normal veya hafif yüksek |
|
Koagulopati |
Var |
Sıkça var |
Fulminan hepatik yetmezlik, 8 hafta içinde gelişen karaciğer hastalığı ile ortaya çıkan nörolojik
tablodur. Özgeçmişinde karaciğer hastalığına ait öykü yoktur. Kronik karaciğer
hastalarında potansiyel geri dönüş ve tedaviye yanıt daha iyi iken akut
(fulminan) karaciğer ensefalopatilerinde hızlı kan amonyak düzeyi yükselmesi
tedavide zorluklar yaratmaktadır. Hızlı amonyak yükselmesi beyin ödemi ve yapısal
beyinsapı hasarına neden olmaktadır. Siroza bağlı ağır karaciğer ensefalopatili
olguların %50sinden fazlası ölümcül seyretmektedir. Karaciğer transplantasyonu da bu hastalar için sınırlı iyilik hali
oluşturmaktadır. Karaciğer transplantasyon adayları
çoğu kez bekleme listesinde iken kaybedilmektedir. Transplantasyon sonrası ilk
5 yılda yaşam şansı %70dir. HE alt
tipleri muhakkak birbirinden ayrılmalıdır (Tablo 1b).
HE için, karaciğer yetmezliği
öyküsü olan kişide serebral fonksiyon bozukluğunu gösteren belirti ve bulgular
tanıyı koydurur. HE epizodunu bir veya birden çok
faktör tetiklemiş olabileceği gibi, bunların bazıları iyatrojeniktir. Bu
tabloyu ortaya çıkarıcı nedenler arasında sedatifler başta gelir (%25).
Gastrointestinal kanama (%18), ilaçla oluşan azotemi (%15) veya azoteminin
diğer nedenleri (%15), aşırı protein alımı (%10), hipokalemi, konstipasyon,
infeksiyon vb. diğer tetikleyici faktörleri oluşturur. Sirozla ilişkili HE si
olan hastalar genellikle bilinç ve uyanıklık düzeyinde değişmeler ile kendini
gösterir. Ayırt ettirici spesifik belirtileri
olmadığından diğer nörolojik hastalıklar, metabolik ve toksik ensefalopatiler
dışlanmalıdır.
Fizik bakıda bilinç etkilenmesi Tablo 2deki gibi
değerlendirilebildiği gibi koma hastalarında kullanılan FOUR (Full outline of
UnResponsiveness) göz hareketleri, motor yanıt, beyinsapı refleksleri ve
solunuma bakılarak da yapılabilir (Bakınız: Komada Pratik Tanı ve Tedavi Yaklaşımları). Kranial sinirler erken evrede normaldir. Işık
refleksi tembelleşir, pupil 3-5 mm açıklıktadır. Okülosefalik refleks
genellikle normaldir. Periyodik lateral, konjuge göz hareketi bozukluğu
görülebilir ve amonyak düzeyinin azalması ile düzelme gösterir. Duyusal
fonksiyonlar korunmuştur. Tonus artışı, motor yavaşlama, ataksi, postür
bozukluğu, derin tendon reflekslerinde artış gibi silik klinik bulgular ve
tremor- asteriksis bulunabilir. Asteriksis ensefalopati
belirtileri klinik olarak aşikar olduğu zaman izlenir.
Bir çeşit motor kontrol bozukluğudur ve miyoklonik postür çözülmeleri ile
kendini gösterir. Tonik aktiviteyi sürdürmekte olan kaslarda görülen istemsiz
50-200 mslik elektriksel sessizlik durumudur. Hastadan kollarını parmakları
açık olarak, dirsekler tam ekstansiyonda, bilekler dorsifleksiyonda olacak
şekilde ileriye uzatması istenir. Karakteristik olarak bileklerde ve
metakarpofalangeal eklemlerde hızlı bir fleksiyon- ekstansiyon (fleksiyon daha
hızlı) hareketi gözlenir. Rijid kaslar (boyun dahil)
ve pasif harekete direnç (paratoni) sık görülür. Ekstansör postür izlenmesi
hastanın 4. evrede olduğunu düşündürmelidir. Nadiren yakalama refleksi
görülür (Bakınız: Sinir Sistemi
Semiyolojisi, İstemsiz Hareketler). Bu dönemde yapılan EEGde trifazik
dalgalar görülebilir. Trifazik dalgalar spesifik
olmamakla birlikte diğer ensefalopatilerde de görülebilir (Şekil 1).
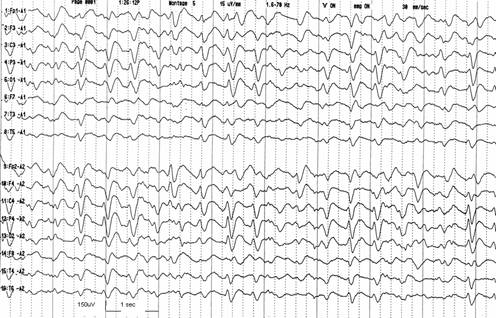
Şekil 1. 46 yaşında kronik karaciğer hastalığı nedeniyle takipli erkek hastada, son birkaç gündür şuurunda değişiklik olması nedeni ile yapılan EEGde hemisfer ön yarılarında trifazik dalgalar izlenmektedir ve intravenöz diazepama yanıt alınamamıştır.
Genellikle laboratuvar testleri ile tanı doğrulanır. Karaciğer
fonksiyon testleri ve bilirubin değerleri yüksektir. Bazen karaciğer fonksiyon
testleri normal olmasına karşın albümin ve pıhtılaşma faktörlerinin seviyesi düşük
ve buna bağlı protrombin zamanı uzamış olabilir. Arteryel kanda amonyak ölçümü
yardımcı olur. Arteryel amonyak seviyeleri ile HE derecesi arasında doğrusal korelasyon yoktur ve bu nedenle klinik olarak belirgin HE
varlığında bu değerlere güvenilemez.
Amonyak için kan alınırken
arteryel kan alınmalıdır. Venöz alındığında veya turnike kullanılıp kas
dokusunda iskemi yaratıldığında normal değerin çok üstünde bulunur. Arteryel
kan alındıktan sonra buz içine yerleştirilip mümkün olan en kısa sürede laboratuvarda
analiz edilmelidir. Gecikme kan içindeki amonyak ürünlerinin
seviyesini yükseltir.
Tablo 2. Hepatik Ensefalopatinin
Derecelendirilmesi
|
|
1. EVRE (hafif) |
2. EVRE (orta) |
3. EVRE (ağır) |
|
Bilinç |
Açık, önemsiz uyanıklık kusuru ve
dikkat menzilinde azalma |
Hafif bilinç bulanıklığı |
Letarjik, somnolan |
|
Davranış |
Kişilik değişikliği, halsizlik,
anormal uyku paterni |
Hafif letarjik, disinhibisyon |
Tuhaf, paranoya |
|
Duygudurum |
İritabl, deprese |
Endişeli, sinirli |
Künt |
|
Kognitif |
Selektif vizyo-spasyal bozukluk |
Bozuk |
Test yapılamayacak kadar bozuk |
|
Nörolojik muayene |
Tremor, asteriksis, canlı
refleksler, Babinski bulgusu |
Bilinç bulanıklığı, dizartri |
Dilate pupiller, nistagmus |
0. Evre: normal sınırlar
içinde, 4. Evre: koma, korunmuş okülosefalik ve ışık refleksleri, ancak
ağrılı uyarana yanıtsız
Elektroensefalografi (EEG), en çok yardımcı olan ve yapılması gereken tetkiklerden bir tanesidir.
Amonyak seviyesi ile paralel olarak EEGde temel aktivitede yavaşlama artar.
Erken dönemde normal temel aktivite veya normal temel aktiviteye karışan önce
teta sonra delta frekansında yavaş dalgalar görülür. Trifazik dalgalar ilk
kez 1955 yılında tanımlanmıştır. Trifazik dalgalar, başlangıcı keskin
karakterli 1,5-3 Hz yavaş dalgalardan oluşur (Bakınız: Elektroensefalografi). HE için patognomonik değil ancak destekleyicidir. Koma
derinleştikçe trifazik dalganın yerini delta frekansında yavaş dalgalar ve
izoelektrik kayıt (elektroserebral sessizlik) alır. Sıklıkla orta ve yüksek
amplitüdlü (100-300μV), düşük frekanslı (1,5-2,5 Hz) jeneralize
paroksismal yavaş dalgalarla karakterize bulgular görülür. EEG değerlendirmesi
yapılırken üç devreye ayrılabilir. İlk dönemde 4-7 Hz teta frekansında yavaş
dalgalar, ikinci dönemde maksimum pozitif defleksiyon ile trifazik dalgalar,
üçüncü dönemde delta frekansında yavaş dalgalar ve nadir bilateral senkroni ile birlikte aritmik yavaşlama olur. Beyinsapı
uyandırılmış potansiyelleri subklinik HE için çok duyarlıdır.
Siroz tanısı
ile izlenen tüm hastaların %60dan fazlasında ensefalopati tablosunu düşündüren
bir klinik bulgu yokken nöropsikolojik testlerle patolojik bulgular saptanır (Tablo
2). Bunları göstermek için iz sürme testi, rakam sembol testi, küp desen
testi ve motor hızı ölçme testi (Purdue Pegboard) yararlıdır. Alkolik sirozu
olan hastalarda bellek bozuklukları alkolik olmayanlara göre daha fazladır. Bu
hastalar dışarıdan ne kadar normal görünseler de özellikle vizyospasyal
bozukluk ensefalopatinin başlangıcında en çarpıcı bulgudur. Laktuloz tedavisi
ile test skorlarının belirgin düzeldiği görülmüştür. Olaya bağlı uyandırılmış
potansiyeller hafif ensefalopati bulguları olanlarda da bozuk
olabilir. Özellikle görsel uyandırılmış potansiyellerde (VEP) latans uzaması ve
bozulmuş dalga formu dikkati çeker. Minimal ensefalopati bulgularının tespiti
için VEP, işitsel P300 ve spesifik nöropsikolojik
testlerin yapılması gereklidir.
Kranial görüntüleme: Manyetik rezonans
görüntüleme (MRG) ve manyetik rezonans spektroskopi (MRS),
hepatik ensefalopati patofizyolojisine yeni bir bakış açısı getirmiştir. T1
ağırlıklı kesitlerde pallidumda sık olarak sinyal artışı olur. Bu bazen
yaygındır, limbik ve ekstrapiramidal sistemi ve genellikle beyaz
cevheri içine alır. MRGde T1 ağırlıklı serilerde bazal gangliada görülen
hiperintens değişiklikler HEnin varlığında ya da yokluğunda rastlanabilen
değişikliklerdir ve bu nedenle HE bakımından anlamlılığı açık değildir. Aynı
zamanda bu değişikliklerin şiddeti ile HEnin derecesi arasında tam bir korelasyon bulunamamıştır. Ancak yapılan çalışmalarda
başarılı karaciğer transplantasyonu sonrası gerilediği
gösterilmiştir. Bu görüntünün altında yatan iki olası neden olarak
manganez birikimi ve astrositik değişiklikler öne sürülmüştür.
MRS bulguları karaciğer transplantasyonu öncesi ve sonrası
bulgular olarak ikiye ayrılıp incelendiğinde: transplantasyon
öncesi miyo-inozitol/kreatin ve kolin/kreatin oranının azaldığı izlenmiştir.
Transplantasyon sonrası oranların tersine döndüğü görülmüştür. Bu
metabolitlerin her birinin yükselmesi veya azalması konusunda birçok spekülasyon vardır. Ancak miyo-inozitol, hepatik
ensefalopati subklinik dönemdeyken tespit edilen bir metabolit olduğu için
duyarlı kabul edilmektedir.
Patofizyoloji
Henüz tam anlaşılamamıştır. Şüphelenilen faktörlerin başında
amonyak değerinin yükselmesi, aminoasitlerin oranının değişmesi,
nörotransmitterlerden GABA (gama-amino-bütirik asit)-benzodiazepin-kompleksi, merkaptan ve kısa zincirli yağ asitleri yer
almaktadır. Kan beyin akımı Evre 0 ve Evre 1 hastalarda normaldir. Ancak
yapılan pozitron emisyon tomografide (PET),
beyin kan akımı ve glikoz metabolizmasının önemli derecede etkilendiği
gösterilmiştir.
Amonyağın rolü: Birçok araştırmada, ensefalopati gelişiminin karaciğer hastalığı
olanlarda, kandaki ekzojen amonyağın miktarı ile ilişkili olduğu
gösterilmiştir. Barsak bakterileri ve mukozal enzimler proteinlerin yıkımına ve
amonyak salınımına neden olurlar. Kan amonyağının artması ile ensefalopatinin
derecesi arasında sıkı bir ilişki vardır, ancak lineer bir korelasyon
yoktur. Uzun sürede yükselen amonyak düzeyi hepatik ensefalopatiye yol
açmayabilir. Diüretik kullanımı veya böbrek yetmezliği de bu yükseklikten
sorumlu olabilir.
Fulminan karaciğer yetmezliğine bağlı HE serebral ödemle
ilişkilidir. Barsak bakterileri ve mukozal enzimler proteinlerin yıkımına ve
amonyak salınımına neden olurlar. Amonyaktan oluşan metabolik ürünler, glutamin
ve onun transaminasyon ürünü ketoglutaramik asit karaciğer hastalığı olanların
beyin omurilik sıvısında (BOS) artmış olarak bulunur. Sonuçta üre siklusu
içinde üreye dönüşür. Beyin içinde astrositik glutamin sentetaz amonyağı ve
glutamatı glutamine çevirir, bu ürün ozmolit gibi hareket eder ve beyin hacmini
arttırır. Tedavi stratejilerinden biri kan amonyak seviyesini düşürmektir ve bu
hastalar için yararlı olabilir. Yapılan çalışmalar kanda amonyak seviyesi iki
katına çıktığı zaman beyinde bu oranın kan düzeyine göre çok daha yüksek
olduğunu göstermiştir. Normal kontrol grubuna göre siroz ve ensefalopatisi olan
hastalarda kan beyin bariyerinin amonyağa karşı geçirgenliğinin belirgin bir
şekilde arttığı bulunmuştur (Şekil 2).
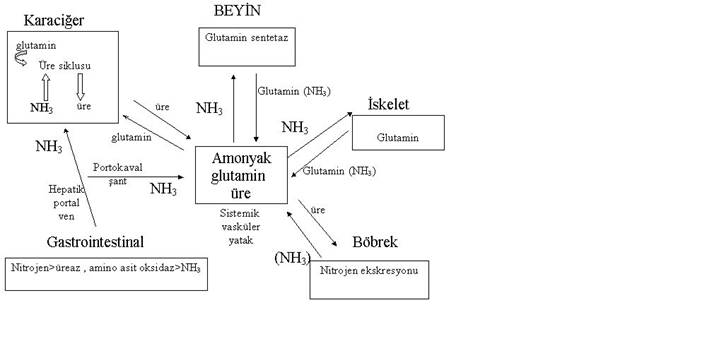
Şekil 2. Hepatik ensefalopatide amonyağın rolü.
Diğer Patofizyolojik
Mekanizmalar
Bozulmuş nörotransmisyonun neden olduğu HE için çeşitli hipotezler
1970lerin başından beri ileri sürülmektedir. Plazma aminoasitlerinin
oranlarının (valin+lösin+izolösin)/ (fenilalanin+tirozin) anormal olması
nedeniyle bu hastalara aminoasit ürünleri verilmiş ve hala verilmektedir. Bu
oran ne kadar normale dönse de, kontrollü klinik çalışmaların sonucu ikna edici
değildir. Diğer bir etken olarak GABA benzodiazepin kompleksinin
potansiyel bozukluğu üzerine olan çalışmalara odaklanılmıştır. Bu çalışmalarda
GABA ile ilişki gösterilemeyince, tüm ilgi benzodiazepinler üzerine
kaymıştır. Birçok anekdotal raporda ise flumazenil verildikten
sonra konvansiyonel tedaviye dirençli olan hastalarda dramatik iyileşmeler
görüldüğü belirtilmiştir. Bu kontrollü çalışmalarda da belirlenmiştir.
HEde benzodiazepin reseptörlerinin periferik tipinin
ekspresyonunun arttığı yönünde yeni teoriler öne sürülmüştür. Buna ek olarak
serebral serotonin ve dopamin metabolizmasının değiştiği ve N-metil-D-aspartat (NMDA)
tipi postsinaptik glutamat reseptörlerinde azalma olduğu belirlenmiştir. Son
çalışmalarda allopregnanolonun GABAA reseptörlerini klorür kanalını
bloke ederek, sonucunda GABAA reseptörleri potansiyelize ettiği
gösterilmiştir.
Yağ Asitleri: Kısa
zincirli yağ asitleri birçok metabolik süreci etkiler, uncoupling
oksidatif fosforilasyon, mitokondriyal respiratuvar süreç değişiklikleri ve
kontrol mekanizmaları, üre siklusunun inhibisyonu gibi olaylar sıra ile
hiperammonyemiye neden olabilir. Deney hayvanlarında koma oluşturmak için
amonyak ile bu yukarıda sayılan olayların sinerjistik çalıştığı gösterilmiştir.
Orta zincirli yağ asit dehidrogenaz aktivitesinde azalma Reye sendromuna benzer klinik tablo yapabilir.
Merkaptan: Thio alkoldür. Bu bileşikte OH grubu yerine SH vardır.
Methanethiol insandaki temel merkaptan, metyoninin katabolizması sonucu meydana
gelir. Kan ve solunan havada ölçülebilir miktarda vardır. Merkaptanın kandaki konsantrasyonu ile ensefalopati derecesi arasında sıkı
ilişki yapılan çalışmalarla gösterilmiştir. Merkaptan; kısa zincirli yağ
asitleri, amonyak veya her ikisi ile birlikte sinerjistik etkide bulunur.
Nöropatoloji
Alzheimer tip II
astrositler, hepatik komanın nöropatolojik tanı koydurucu hücreleridir. Bu
hücreler, serebral korteks, talamus, lentiküler, dentat ve ruber
çekirdeklerinde komanın süresi ile korele olacak şekilde izlenirler.
Oligodendroglial hücreler etkilense de HEnin bir astrositik hastalık olduğu
düşünülmektedir. Bu hastaların beyinlerinde beyaz cevher, bazal ganglia ve
serebellumda, korteksin 5. ve 6. tabakasında polimikrokaviter dejeneratif değişiklikler
görülür. Kronik HEde astrositlerin büyüdüğü ve soluk hale geldiği izlenir.
Periodik Asit Schiff (PAS) boyası ile pozitif reaksiyon veren intranüklear
inklüzyonlar da mevcuttur.
Tedavi
Hastaların tedavisi sırasında hepatolog, cerrah, nörolog ve
psikolog arasında iyi bir işbirliği olmalıdır. Ensefalopatinin ilk dönemde fark
edilmesi ve altta yatan tetikleyici faktörlerin (infeksiyon, elektrolit
dengesizliği, gastrointestinal kanama, ilaç kullanımı) tespiti ve tedavisi bu
hastalığın morbiditesi ve mortalitesini aşağılara çekecektir. HEnin
patogenezinden sorumlu olan amonyağın büyük bir kısmı kolon kaynaklıdır.
Dikkatli şekilde diyet kontrolü, lavmanla barsak boşaltması yapılmalı, neomisin gibi
barsaktan emilmeyen veya az emilen (%3) antibiyotikler verilmelidir. Laktuloz hem
akut hem de kronik dönemde verilen, kolondaki bakteriler tarafından asit
oluşturmak için metabolize edilen sentetik bir disakkariddir. Osmotik diyareye
neden olur. Asidifikasyon amonyağı absorbe edilmeyen iyonize formuna
dönüştürür. Nitrojen içeren maddelerin deaminasyonu azaltılarak amonyağın
barsaktan absorbe olmadan atılımı sağlanmış olmaktadır. Günde üç veya dört kez
20-30 g verilmelidir. Bu miktar kişiye günde 2-3 kez defekasyon yaptırır. Bir
başka sentetik disakkarid ise laktitoldür. Aminoasitler, yararlı etkileri henüz
gösterilememiş olmasına rağmen hala kullanılmaktadır. Dallı-zincirli
aminoasitlerle kan aminoasit profili normale
getirilmeye ve ensefalopati tedavi edilmeye çalışılmaktadır. Diyet, tedavinin
önemli bir parçasıdır. Protein alımının kısıtlanması ve sadece ihtiyaç olan
proteinin (esansiyel aminoasitler) alınması gerekir. Bazen sadece diyet
(probiyotik) bile ensefalopati tablosunun kontrol altına alınmasına yardımcı
olabilir. L-ornitin-L-aspartat intravenöz olarak laktuloz ile iyi yanıt
alınamayan olgularda amonyak seviyesini düşürmektedir. Neomisin ve rifaksimin
üreaz üreten bakterileri yok ederler. Laktulozdan daha etkili değildirler.
Laktuloz ile birlikte kullanılan rifaksiminin günde iki kez 550 mg verilmesinin
barsaktaki mikroorganizma çeşitliliğini değiştirdiği, hastane yatış süresini
azalttığı belirlenmiştir.
Amonyağın yükselmesi ile oluşan beyin ödemi tedavisi de önemlidir.
Mannitol, hipertonik salin kontrollü olarak verilebilir. Tedaviyi takip için
intrakranial basınç monitorizayonu yapılabilir. Hemoraji riskini önlemek için
INR ve protrombin- kompleksi ve faktör VII takibi
yapılmalıdır.
Cerrahi tedavi olarak portosistemik şant ve son dönem karaciğer
yetmezliğinde transplantasyon düşünülmelidir. Fulminan
hepatik yetmezlik olan her 5 hastadan sadece biri transplantasyon
şansını yakalamaktadır. Transplantasyon cerrahisi öncesi hazırlık döneminde
yapılan moleküler adsorban tekrarlayan dolaşım sistemi (MARS) bir tür diyaliz
yöntemidir ve koagülopatiyi kötüleştirip intrakranial kanama riskini
arttırabilir.
Komplikasyon ve Prognoz
Bazen erken bulgular fark edilemeyebileceği için, gerçek HE
insidansının daha yüksek olduğu tahmin edilmektedir. HE tamamen geri dönebilen
bir tablo olduğu için erken tanının önemi bir kez daha ortaya çıkmaktadır. Uzun
süren ve sık tekrarlayan epizodlar kliniğin geri dönüşünü etkileyip sabit ve
progresif nörolojik tabloya neden olabilir. Demans, dizartri, ataksi,
intansiyonel tremor ve koreoatetoz kalıcı olabilir. Örneğin spastik parapleji,
omuriliğin hasarlandığını gösterir ve bu komplikasyon
hepatoserebral dejenerasyonun sadece bir parçasıdır. Dikkatli bir şekilde erken
miyelopati nedenlerini araştırmak gereklidir. Hastalar yoğun bakım altında ve
en iyi şartlarda tedavi verilse bile komadaki bir hepatik ensefalopatili
hastada mortalite %80-85dir.
Karaciğer transplantasyonu
tedavi için bir başka seçenektir. Ancak onun da yaratacağı komplikasyon
ve ortaya çıkaracağı nörolojik problemler bu tabloları daha karmaşık hale
getirebilir.
ÜREMİK ENSEFALOPATİ
Üremik ensefalopati tedavi edilmemiş böbrek yetmezliği veya
diyaliz ile ilişkili olan organik beyin sendromudur.
Böbrek yetmezliğine yol açan birçok hastalık; hipertansiyon, sistemik lupus
eritematozus, diabetes mellitus (DM) ve diğerleri merkezi sinir sistemi
bozukluğu ile sıkı ilişkilidir. Akut böbrek yetmezliğinde hem
ensefalopati ağırdır hem de progresyon hızlıdır. Erken dönemde yorgunluk,
apati, konsantrasyon bozukluğu olur. Dikkat testleri
sıklıkla bozuktur. Ensefalopati ilerledikçe bellek bozukluğu ve inaktivasyon,
anlamanın bozulması, uyku düzeni değişiklikleri olur. Diğer ensefalopatilerde
olduğu gibi dizartri, yürüme bozukluğu, asteriksis, aksiyon tremoru, multifokal
miyoklonus ve bilinç bulanıklığı gibi nörolojik bulgular izlenir. Üremik
ensefalopatinin en erken güvenilir göstergesi bilinç bulanıklığıdır. Frontal
lob semptomları olarak, soyutlama zorluğu ve davranış
değişiklikleri belirginleşir. Paratoni, yakalama ve palmomental refleksler,
frontal lob etkilenmesine bağlı olarak ortaya çıkar. Huzursuz bacak sendromu üremik hastaların %40ında görülür. Muhtemelen bir
ensefalopati semptomudur. Ensefalopati ilerledikçe
ekstremite tonusunda değişiklikler olur ve beyinsapı fonksiyonları bozulur. Kas
tonusu artmıştır ve bazen asimetriktir. Hastaların %20sinde fokal motor
bulgular görülür ve sıklıkla hemodiyalizden sonra kaybolur. İleri dönemde,
hastada deliryum, görsel halüsinasyonlar, dezoryantasyon, ajitasyon olabilir, preterminal koma ve konvülziyonlara
dönüşebilir. Fokal motor nöbet de görülmesine karşın, genellikle jeneralize
tonik-klonik nöbetler olur. Epilepsia parsiyalis kontinua, jeneralize nöbet
öncesinde görülebilir. Üremide nöbet eşiğinin düşmesindeki mekanizma bilinmemektedir.
Yüksek dozda penisilin verildiğinde deliryum, asteriksis, miyoklonus ve
konvülziyonlar olur. Penisilin intoksikasyonu ile üremik ensefalopatinin
nörolojik bulgularındaki benzerlik nedeniyle birtakım spekülasyonlar
vardır. Ancak açıklık kazanmamıştır. Meningismus görülebilir. Gerekli olan
renal replasman tedavisi verilse bile semptomlar
değişmeyebilir ve yaşam kalitesi kötüleşebilir. Nöropsikolojik testler, hangi
tedaviyi alırsa alsın bu hastaların normalden sapma gösterdiklerini ortaya
koymuştur. Uygulanan diyaliz metodunun dikkat, cevap hızı, öğrenme, bellek
gibi testlerde farklılık göstermediği anlaşılmıştır. Azotemi ile
nöropsikolojik testlerdeki bozulma arasında korelasyon
gösterilememiştir. Meningismusu olan hastada BOSta aseptik menenjit tespit
edilebilir. Bu dönemde yapılan BOS incelemesinde mm3 te 250ye
kadar lenfosit ve polimorfonükleer lökosit olabilir. BOS proteini 1 g/L kadar
yükselebilir. Ayırıcı tanıda görüntüleme yöntemleri önemli bir yer tutar. Diğer
konfüzyon nedenleri arasında yer alan subdural hematom ve hidrosefali kranial
görüntüleme ile (BT/MRG) tespit edilir. Ancak üremik ensefalopatinin tipik bir
görüntüleme bulgusu yoktur. Serebral atrofi olabilir. MRG ile periventriküler
beyaz cevher, bazal ganglia ve internal kapsülde T2 ağırlıklı kesitlerde
hiperintens, T1 ağırlıklı kesitlerde hipointens sinyal değişiklikleri görülür.
Bu lezyonlar genellikle diyaliz sonrası kaybolurlar.
Akut böbrek
yetmezliğinin ilk 48 saatinde EEG genellikle bozuktur. Kronik böbrek hastalarının hepsi ve akut börek yetmezliği olanların büyük bir
kısmında temel aktivite yavaşlar, alfa aktivitesine 5-7 Hz teta frekansında
yavaş dalgalar katılır. Paroksismal delta frekansında jeneralize yavaş dalgalar
izlenebilir. Temel aktivitenin baskılanmasından çok göz kapaklarının açılması
ile artan parodoksal yanıt görülür. Diğer bir bulgu olarak da senkron bilateral delta frekansında yavaş dalga şeklinde
paroksismal aktivite uyanma sırasında ortaya çıkar. Anormal bir yanıttır.
Epileptiform anomali görülmesi sık değildir. Trifazik
dalgalar görülebilir. Trifazik dalgalar en çok ağır azotemi, dekompanse kronik
böbrek yetmezliğinde görülür. Bilinç değişikliği somnolanstan komaya kadar
değişir ve tablo ilerledikçe EEG yavaşlaması artar. Artan serum
kreatinini ile EEGdeki yavaşlama arasında korelasyon
belirgindir.
Bazen primer hastalık
veya üreminin sekonder etkilerini birbirinden ayırmak zor olabilir. Aynı
şekilde bu zorluk böbrek hastalığının progresyonu ile diyalize bağlı
gelişen disequibilirium ve demans sendromları, transplantasyon ve immünsupresyon komplikasyonları için de
geçerlidir. Renal transplantasyon yapılan hasta
sayısının artması, transplantasyon rejeksiyonunun yeni geliştirilen ilaçlarla
önlenmesi, gelecekte daha karışık tablolar ile uğraşılacağını
düşündürmektedir.
Patofizyoloji
Üremik ensefalopati patofizyolojisi çok iyi bilinmemektedir.
Kronik böbrek yetmezliği nedeniyle ölen kişilerin beynindeki değişiklikler
hafif ve spesifik olmayan bulgulardır. Ancak kalsiyum seviyesi
serebral kortekste normale göre iki kat artmıştır. Bu artış paratiroid
aktivitesi ile ilişkilidir. Deneysel çalışmalar; akut böbrek yetmezliği
başlangıcında beyin kalsiyum miktarı ve serum paratiroid hormon seviyesinin iki
katına çıktığını göstermiştir. EEGdeki yavaşlama parathormonun N-terminal
kısmının plazmada yükselmesi ile ilişkili bulunmuştur. 1,25 dihidroksi vitamin
D ile EEG bulguları düzelir ve parathormonun N-terminal kısmı düzeyi plazmada
düşer. Beyin kalsiyum konsantrasyonu, ATPye bağlı
Na-Ca taşıyıcı proteinin aktivitesi ile ilişkilidir. Köpeklerde yapılan
akut ve kronik böbrek yetmezliği deneysel modellerinde, hem EEG hem de beyin
kalsiyum bozukluklarının paratiroidektomi ile önlenebildiği görülmüştür.
Böbrek yetmezliğinde
beynin metabolik hızı ve dolayısıyla serebral oksijen tüketimi azalmıştır.
Normal konsantrasyonda yüksek enerjili fosfatların
olmasına karşın bu azalmanın bir açıklaması, metabolik azalmaya yol açan
nörotransmisyonun azalması olabilir. Üremik hastalarda parathormona bağımlı
kalsiyum transportu vardır (sodyum/kalsiyum değiştiricisi ve kalsiyum
ATPaz pompası). Oubaine duyarlı Na/K-ATPaz pompası aktivitesinin, hem akut hem
de kronik üremide azaldığı gösterilmiştir. Bu pompanın en önemli özelliği
biyojenik amin gibi nörotransmitterlerin salınımını
yapmasıdır. Bu sinaptik fonksiyon bozukluğu ile nörotransmitter azalması
üremik farelerde izlenmiştir. Hayvan modellerinde GABA ve glisin üzerinde
özellikle guanidinosüksinik asitin inhibitör etki yaptığı ve muhtemelen klor
kanallarını bloke ederek nörotransmitter salınımını bozduğu gösterilmiştir. Bu
maddenin böbrek yetmezliğinde beyin ve BOSta yükseldiği bulunmuştur. Ek olarak
metilguanidinin, Na/K-ATPaz pompa aktivitesini inhibe ettiği izlenmiştir.
Kronik üremik ensefalopatili hastalarda alüminyumun rolü hala kesin olarak
bilinmemektedir. Bu metalin kaynağı diyet yoluyla ve fosfat bağlayan ilaçlarla
alım olabilir. Alüminyumun beyne transportu, beyin kapiller endotel
hücrelerinin luminal yüzeyinden transferrin reseptörleri ile olmaktadır.
Beyinde alüminyum, Aβ42 prekürsör proteinin ekspresyonunu
etkileyebilir. Senil plakların içinde amiloidojenik Aβ42 proteinin
ektraselüler birikimine yol açar. Alzheimer benzeri değişiklikler, nörofibriler
ağsı yapı gibi olabilir ama diyalize giren hastalarda serebral kortekste
genellikle bulunmaz. Üremik ensefalopati, nörotransmitter dengesizliği ile
ilişkilidir. Plazma aminoasitlerinden en çok glutamin, glisin, aromatik ve dallı zincirli aminoasitler ve potansiyel olarak
GABA, dopamin ve serotonin seviyeleri ile yakından ilgilidir. Ancak henüz bu
hipotezler ispatlanmamıştır.
Tedavi
Üremik ensefalopatinin
primer tedavisi diyalizdir. Genellikle hemodiyaliz, periton diyalizine göre
tercih edilir. Diyaliz ile durum stabilleştirildikten sonra renal transplantasyon yapılabilir. Üremik hastaların 1/3ü
epileptik nöbetler geçirir. Nöbetlerin üremiye mi yoksa altta yatan hastalığa
mı (malign hipertansiyona bağlı ensefalopati, infeksiyonlar, dialysis
disequilibirium sendromu veya serebral
infarktlar) bağlı olarak ortaya çıktığı bulunmalıdır.
Tekrarlayan üremik
konvülziyonların tedavisi basit değildir. Üremik hastalarda ilaç plazma düzeyi
kontrol grubunun sonuçlarının %25i kadardır, yani düşüktür. Düşük plazma ilaç
düzeyine karşın üremik hastalarda antiepileptik (AEİ) ilaçlara cevap iyidir.
Çünkü nöronal membranı geçerken difüzyon hızı serbest ilaç konsantrasyonu
ile orantılıdır. Üremik hastalarda total plazma düzeyine bakılması sınırlı bir
sonuç verir. Klinik problemi çözmek için hem serbest hem de total düzeye
bakılmalıdır. Difenilhidantoinin (DPH) plazmadaki diğer
maddelerle yarışmaya girmesi, DPHnin serbest kalmasına ve sonuçta
dokulara girişinin artmasına neden olur. Fenobarbital doz
ayarlaması sonucu, sedasyon yapmaksızın etkisini gösterebilir. Erişkinlerde
90-180mg/gün dozuna yavaş yavaş çıkılmalı ve aralıklarla ilaç düzeyine
bakılmalıdır. Status epileptikus çok sık görülmemekle birlikte acil girişim
normal kişilere yapılan tedavinin aynısıdır. DPH ve diazepam verilebilir.
Tedavinin
komplikasyonları
Diyaliz böbrek yetmezliği olan hastalar
için yaşamın devamını sağlayan önemli bir tedavi biçimi olmasına rağmen, bunun
ile ilişkili iki önemli nörolojik sendrom
tanımlanmıştır.
Dialysis disequibilirium: Akut gelişir, diyaliz sırasında veya tek bir
diyaliz tedavisinden sonra görülebilir. Semptomlar hafif bulgulardan ölüme
kadar değişik ve geniş bir yelpazede görülür. 1970 öncesinde sık rastlanan bu
tablo, diyaliz tekniklerinin gelişmesi ile artık nadir olarak görülmektedir.
Çocuklar ve yaşlılarda daha sıktır. Semptomlar diyaliz sonuna doğru artar,
birkaç saat sürer. Deliryum ve miyoklonus ile karakterize ağır tipleri birkaç
gün sürer. Jeneralize nöbet, papilödem, intraoküler basınç artışı ve kardiyak
aritmi olur. Diğer semptomlar arasında oryantasyon
bozukluğu, başağrısı, bulantı, yorgunluk, kramplar, titremeler olabilir. Bu semptomları serebral ödem gelişmesine bağlamak mümkündür.
Üremik hastalarda üre ve idyojenik osmol birikimine bağlı olarak
serum ve beyin osmotik gradyenti artar. Hızlı şekilde hemodiyaliz yapıldığında
yavaş yapılan diyalize göre beynin su ve osmol miktarının arttığı bulunmuştur.
Hemodiyaliz ister yavaş ister hızlı olsun BOS ve beyin üre konsantrasyonu,
plazma konsantrasyonundan çok yüksektir. Relatif olarak beyinde su birikimi ve
sonuçta beyin şişmesi olur. İdyojenik osmoller bu sendromun
gelişiminde kritik bir öneme sahiptir. Yavaş yapılan diyalizde bu idyojenik
osmollerden beynin kurtulması daha kolaydır ve bu nedenle daha az ödem gelişme
ihtimali vardır.
Diyaliz demansı: Kronik bir süreçtir. Uzun süreli diyaliz
tedavisinden sonra subakut ve kronik olarak gelişir. Çok nadir ve ağır bir
tablodur. Tedavi edilmezse ölümcüldür. Subakut gelişen bellek bozukluğu ile
kişilik değişikliği, apraktik-disartrik konuşma, miyoklonus, nöbetler
(genellikle multifokal) olur. Erken bulgulardan birisi, %95inde mikst tip
dizartri ve disfazi ile disgrafinin bulunmasıdır. Hastalık ilerledikçe konuşma
fonksiyonu kötüleşir ve vakaların %80inde miyokloni görülür. EEGde ise
yavaşlamış temel aktiviteye multifokal olarak keskin ve yavaş dalga
deşarjlarının karıştığı görülür. Diyaliz sıvısındaki alüminyum içeriği ile sendromun ilişkisi hakkındaki epidemiyolojik çalışmalar,
alüminyumun muhtemel kaynağının diyaliz sıvısı olduğunu ortaya koymuştur ve
birçok vakada sendromun en olası sebebidir. Bu sendromda
hastaların beyin hücrelerinde alüminyum seviyesi artar. Oral fosfat bağlayan
ilaçların içinde alüminyum olması kaynağın bu ilaçlar olduğunu baştan
düşündürdüyse de oral alüminyumun primer kaynak olmadığı gösterilmiştir.
Kullanılan içme sularında yüksek oranda alüminyum saptanan bölgelerdeki
hastalarda bu sendromun sık olarak görüldüğü
belirtilmektedir. Alüminyumun diyaliz solüsyonlarından çıkarılması ile bu sendromun insidansında belirgin düşme izlenmiştir. Her ne
kadar bu sendromun nedeni diyaliz solüsyonundaki
alüminyuma bağlandıysa da, bazı merkezlerde alüminyum seviyesi düşük olsa da
nedeni açıklanamayan sporadik vakalar vardır. Gastrointestinal alüminyumun
absorpsiyonu bu hastalığın patogenezinde zaman zaman önemli olduğunu
düşündürür. Patofizyolojileri anlaşıldıkça bu sendromların
tedavi ve profilaksisi daha başarılı olmaktadır. Tedavi edilmeyen hastalarda
ölüm 6-9 ayda olur.
Wernicke
ensefalopatisi: Demans, oftalmopleji ve ataksi triadı olan tiamin
eksikliğine bağlı ortaya çıkan bir ensefalopatidir. Diyaliz sırasında
replasmanı yapılmazsa kronik böbrek yetmezliği hastalarında görülme riski
vardır. Oral tiamin kullanımı bulantı-kusması, kaşeksisi olan üremik hastalarda
yetersiz kalabilir.
GLİKOZ METABOLİZMASI BOZUKLUKLARI
Normal koşullar altında
beynin tek enerji kaynağı glikozdur. Karaciğer ve iskelet kası gibi
organlar glikozu glikojene çevirip saklayabilir. Beyin ise glikozun çok az bir
kısmını glikojen şeklinde saklayabilir. Beyin glikoz konsantrasyonu,
plazma glikoz konsantrasyonunun %25i kadardır, yani düşüktür. Glikozun
beyindeki metabolizma hızı yüksektir ve beyne glikoz sağlanmasındaki aksama ve
gecikme tehlikeli olabilir. Hiperglisemi, hipoglisemiden daha iyi tolere
edilir. Fakat hipergliseminin osmotik etkisinden dolayı da büyük oranda
nörolojik semptomlar ortaya çıkar.
Yemek yendikten sonra
kan glikoz seviyesi yükselmeye başlar. Birçok karmaşık faktörün de eşlik ettiği
bu durum sonucunda insülin salınır. Glikozun bir kısmı glikojen şeklinde
karaciğerde depo edilir. Normal şartlar altında karaciğerde 24-36 saat kan
şekerini 80-90 mg/dl tutmaya yetecek glikojen deposu vardır. Bu süreden sonra
yeterli kan şekeri düzeyi elde etmek için glikoneogenez devreye girer.
Aminoasit alanin ve glutamin, ayrıca laktat ve piruvat önemli
glikoz prekürsörleridir. Glukoneogenez en çok karaciğerde olur. Açlık süresi
uzadıkça böbrek glikozun yaklaşık yarısını üretmeye başlar. Bu üretilen şekerin
yarısı beyin tarafından metabolize edilir.
Normal koşullarda 100 g
beyin dokusunda kan akımı 50 ml/dk dır ve yaklaşık
glikoz konsantrasyonu 5 mmol/L olur. Michaelis Menten kinetiğine göre
glikoz transport enzimleri kan beyin bariyerinden bu totalin yaklaşık
%10unu geçirir. Kan beyin bariyerini geçişte glikoz transportunda
defekt, birçok çocukta devamlı düşük BOS glikozu, nöbetler ve gelişme geriliği
yapar. Glikozun büyük kısmı glikolitik yolla metabolize olur ve trikarboksilik
asit siklusunu kullanarak gerekli ATPyi sağlayıp beyin fonksiyonlarını idame
ettirir. Beyne giren glikozun %85i bu şekilde metabolize olur. Geri kalanı
heksoz monofosfat şantı ile metabolize olup glikojene çevrilir.
Hipoglisemi
Uluslararası Hipoglisemi
Çalışma Grubunun tanımladığı üç tip hipoglisemi vardır. Seviye 1 (eşik seviye) ≤70
mg/dl (3.9 mmol/l), Seviye 2 (klinik olarak
hipoglisemi) ≤54 mg/dl (3.0 mmol/l),
Seviye 3 (ağır hipoglisemi) ≤40 mg/dl (2.2 mmol/l) dir. Bu
düzeyler hipoglisemiye vücudun verdiği yanıta ve serebral kan akımın etkisine göre
belirlenmiştir. Serum
glikozu ≤70 mg/dl düzeyinden düşük olduğunda hasta hipoglisemi
tanısını almaktadır.
Hipogliseminin Klinik Tipleri
Kan glikoz düzeyi çok
düşük olduğu zaman bile hipoglisemi semptomları çok değişik
tablolar halinde görülebilir. Üç sendrom
tanımlanmıştır.
1- Akut sendrom: Kısa etkili insülin ve sulfonilüre gibi
oral antihiperglisemik ilaçların etkisiyle halsizlik, çevreden kopma hissi,
huzursuzluk, açlık, terleme, ataksi, sinirlilik, bazen panik hali olabilir.
Hastalar bu semptomları tanıyabilirler. Oral ve
parenteral glikoz verilince semptomlar hemen kaybolur.
EEGde bu dönemde spesifik olmayan bulgular olabilir.
Ataklar spontan sonlanır veya hızlıca jeneralize nöbetlere ve komaya dönüp
kalıcı beyin hasarına neden olabilir.
2- Subakut sendrom: Açlık sırasında spontan hipogliseminin
geliştiği olgulardır. En çok görülen hipoglisemi formudur. Akut sendrom sırasında görülen semptomların birçoğu görülmez. Bu
epizod için hasta amnestik olmasına rağmen, dikkati korunmuştur. Ancak yukarıda
sayılan semptomların yerine düşünce sürecinde
yavaşlama ve bilinçte bulanıklık vardır. Tanıyı koymak zor olabilir.
Özellikle açıklanamayan hipotermi olgularında vücut sıcaklığının ve kan glikoz
takibinin eş zamanlı ve sık yapılması tanı koydurucu olabilir.
3- Kronik hipoglisemi: Çok nadirdir. İnsülin salgılayan
tümörlerde veya obsesif bir şekilde çok iyi kontrol
edilen diyabetik kişilerde görülür. Plazma C proteinine bakmak tanı için
önemlidir. Kişilik, davranış ve bellek değişiklikleri ile karakterizedir ve
bazen demans olarak yorumlanabilir. Akut ve subakut tiplerde olduğu gibi acilen
glikoz verilmesinin yararı olmaz. Çünkü nöronal hasar zaten oluşmuştur.
Konsantrasyon güçlüğü, kuvvetsizlik ve sersemlik hissi nöroglikopeniye
bağlanmalıdır. Açlık hissi, görme bulanıklığı ve diğer semptomlar
çok belirsizdir.
Hipoglisemi için ortaya
çıkan öncü belirtilerin farkında olmayan diyabetik kişide de hipoglisemi
olabilir. Tip I DM hastalarının tüm epizodlarının %17sinde tam veya kısmen bu
tip farkında olmadan ortaya çıkan hipoglisemiler görülür. Altta yatan mekanizma
olarak nöroendokrin yanıtın değişmesi ve MSSde gelişen semptomları
algılama ve analiz etme yeteneğinin bozulmasının rol oynayabileceği öne
sürülmektedir.
Rutin incelemeler
sırasında tanı konusunda herhangi bir şüphe varsa doktor ısrarcı olmalı ve kan
glikoz takip çizelgesini yaptırmalıdır. Bu tanının atlanması hastada geri
dönüşü olmayan nöronal hasar yapacağı için parenteral glikoz ile olası tedaviyi
yapmak gereklidir.
Hipogliseminin nedenleri
(Tablo 3) arasında ilaçlar önemli bir yer tutar. Yaşa bağlı değişen
nedenler arasında neonatal dönemde annenin sulfonilüre kullanımı, 0-2 yaş arasında
salisilat alımı, 2-7 yaş arasında alkol içeren öksürük şurubu kullanımı
hipoglisemi nedeni olarak sayılmaktadır. Gene sulfonilüre gibi ilaçlar, 11-30
ve 50 yaş ve üzerinde olanlarda hipoglisemiden sorumludur. Alkol, 30-50 yaş
arasında en önemli neden haline gelir.
Hastaların önemli
kısmında beta bloker kullanımı vardır. Hipoglisemi semptomları,
bu ilaçla maskelendiği için insülin veya oral hipoglisemik ilaç alan kişilere
beta bloker verilmemelidir. DM hastalığına ek başka hastalıkların olması (ciddi
absorpsiyon bozukluğu yapan hastalıklar, üremi, karaciğer hastalığı,
infeksiyon, şok, gebelik, kanser, yanık vb.) hipoglisemi gelişmesi için
predispozan faktörlerdir.
Nedeni bilinmeyen bir koma nedeniyle acil
polikliniğe başvuran hastalarda laboratuvara gönderilmek üzere kan alındıktan
sonra parenteral hipertonik glikoz solüsyonları verilmelidir.
Tablo 3. Hipoglisemi nedenleri
|
1. Postprandiyal
hipoglisemi |
Postoperatif hızlı gastrik boşalım (alimenter
hiperinsülinizm) Fruktoz intoleransı Galaktozemi Lösin intoleransı İdyopatik |
|
2. Açlık
hipoglisemisi |
|
|
a. Glikozun
aşırı kullanımı a-1.Yükselmiş
insülin seviyesi |
Ekzojen insülin (tedavi, kötü niyetle) Oral hipoglisemik tedavi, kötü niyetle Adacık hücre bozukluğu (adenom, nesidioblastosis, kanser) Aşırı adacık hücre fonksiyonu (prediyabet, şişmanlık) Endojen insüline karşı antikor oluşumu Ketotik hipoglisemi |
|
a-2. Normal
/ düşük insülin
seviyesi |
Hipermetabolik durum (sepsis) Nadir ekstra pankreatik tümörler Karnitin eksikliği Endojen insüline karşı antikor oluşumu |
|
b. Glikozun
az üretilmesi |
|
|
b-1. Hormon
eksikliği |
Büyüme hormonu, glukagon, hipoadrenalizm |
|
b-2. Enzim
bozukluğu |
Glikojen metabolizması (glikojen fosforilaz, glikojen
sentetaz) Heksoz metabolizması ( glikoz 6 fosfataz, fruktoz 1,6
bifosfataz) Glikoliz, Krebs siklusu (fosfoenolpiruvat karboksikinaz,
piruvat karboksilaz, malat dehidrogenaz) |
|
b-3. Alkol
ve diğer ilaçlar |
|
|
b-4. Karaciğer
hastalığı (siroz, fulminan hepatik yetmezlik) |
|
|
b-5. Ağır
malnütrisyon |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
EEGde önce tetalar
belirir, stupor ile birlikte delta aktivitesi dominant hale gelir. Artan teta
ve delta aktivitesi serebral monoamin (serotonin, noradrenalin, dopamin) düzeylerinde
değişiklere neden olur. Plazma membran iyon kanalı fonksiyonları bozulur ve
nöronal eksitabilitedeki değişiklikler klinik ensefalopati tablosuna neden
olur. Hipoglisemi düzeltilmemişse selektif nöronal nekroz ve kalıcı beyin
hasarı 30 dakikalık izoelektriksel dönemden sonra gerçekleşir. Difüzyon
ağırlıklı kranial MRGde simetrik ve asimetrik fokal sitotoksik ödeme bağlı
geri dönüşü olan lezyonlar olur. Kritik süre içinde tedavi edilirse kalıcı
olmaz. Bu lezyonlar damar sulama alanlarının dışındadır. Bu lezyonlar T1 ve T2
ağırlıklı kesitlerde görülüyorsa geri dönüşümsüzdür. Tutulum olmayan bölgeler
talamik ve serebellar bölgelerdir.
Tedavi
Hipoglisemi düzeyi çok
düşük bulunan hastalarda agresif ve devamlı tedavi ve
monitorizasyon yapmak gereklidir. Antihiperglisemik ilaç toksisitesi
araştırılmalıdır. Bolus intravenöz 50 ml %50 içeren glikoz verilmeli takiben %5
glikoz devam edilmelidir. Serum glikoz düzeylerine yarım saatte bir
bakılmalıdır. Bu durum hasta yemek yemeye başlayıncaya kadar veya bilinci
açılıncaya kadar devam etmelidir. Hipoglisemi nedenleri (Tablo 3) araştırılmalıdır.
Hiperglisemi
Hipergliseminin birçok
nedeni olmasına karşın diyabetik ketoasidoz (DKA), nonketotik
hiperosmolar koma ve iyatrojenik faktörler (parenteral hiperalimentasyon)
önemli yer tutar. Tip I DMlilerde DKA, diğer nedenlere göre daha fazla
görülür. Hiperglisemi glikozun 7,8 mmol/L (140 mg/dL) değerinden daha yüksek
bulunmasıdır. Bilincin bozulması ile giden ensefalopati için kan şekeri 16,7
mmol/L (300 mg/dl)den yüksek olmalıdır. Stabil olan hastada sıklıkla
infeksiyonun tetiklediği hiperglisemi günler içinde gelişir ve glikozürinin
oluşturduğu osmotik diürez, osmotik diürezin neden olduğu poliüri ve polidipsi
olur. Bu semptomları takiben anoreksia, bulantı, oryantasyon
bozukluğu ve koma meydana gelir. Fizik muayenede devamlı ve derin
hiperventilasyon, özellikle ciddi asidoz bulguları olan hastalarda bu tanı
düşünülmelidir. Ancak laboratuvar olarak kan şekeri, arter kan gazı,
elektrolitler ve keton cisimlerine bakıldıktan sonra tanı konup tedaviye
başlanmalıdır.
Nonketotik hiperosmolar
koma en çok tip II DMlilerde ve yaşlı hastalarda görülür, DMin ilk
belirtisi olarak sıkça karşılaşılır. DKAya göre daha yavaş gelişir. Uzun
süreli poliüri ve bunu takiben ağır dehidratasyon gelişir. Hiperosmolalitenin
diğer semptom ve belirtileri, hipovolemi, nöbet gibi
serebral fonksiyon bozukluğu gösteren bulgulardır. İnfeksiyon, gastroenterit,
pankreatit, glukokortikoid ve difenilhidantoin ile tedavi presipite eden
faktörlerdir.
Glikoz metabolizması bozukluklarında DKAla birlikte nadiren
epileptik nöbetler görülür. Buna karşılık hipoglisemide olduğu gibi nonketotik
hiperglisemi (NKH) de epileptik nöbetlerin başlıca eşlik ettiği durumdur (Şekil 3). Hastaların %25inde epileptik
nöbetler vardır. En sıklıkla epilepsia
parsiyalis kontinua gibi fokal motor nöbetler görülür ve sıklıkla bilinç
bozulması ile birliktedir.
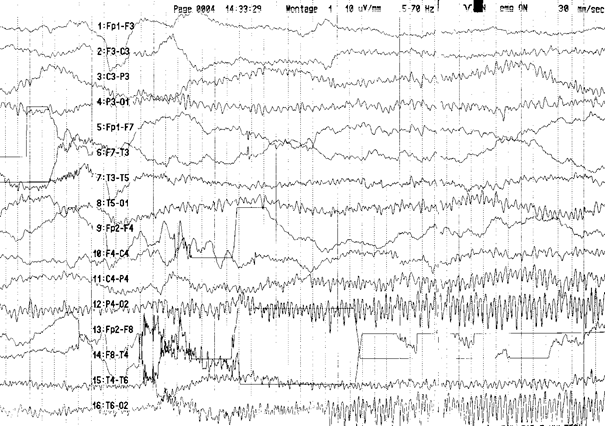
Şekil 3 . 54 yaşında 15 yıldır tip 2 diabetes mellitus tanısı ile izlenen ve son aylarda diyetine dikkat etmeyen ve oral antidiyabetik ilaçlarını düzensiz alan erkek hasta acil servise baktığı cisimleri olduğunda büyük görme (makropsi) şikayeti ile başvurmuştur. Yapılan incelemelerinde kan şekeri yüksek (404 mg/dL) saptanmıştır. EEG trasesinde sağ oksipital bölgede ritmik nöbet aktivitesi (iktal kayıt) izlemektedir.
NKHde epileptik nöbetler dışında çeşitli motor belirtiler
(miyoklonus, distoni, koreoatetoz) veya fokal defisitler (parezi, afazi) de
olabilir. NKHde fokal nöbetler veya diskineziler genellikle yapısal bir
lezyonla birlikte değildir. Epileptik fokal nöbetler veya genellikle
hemikore/hemiballismus gibi istemsiz hareketler olduğunda glikoz serum konsantrasyonu 21,6-50 mmol/L arasında bulunmaktadır.
DKAda hiperglisemik tablo tedavisi yeterli yapılmazsa önemli
derecede morbidite ve mortaliteye sebep olur. İnsülin yokluğunda, periferik
glikoz alımı ve glikojen yapımı azalır. Glukojenoliz ve lipoliz artar, bunun
sonucu asidik keton artar ve hiperglisemi olur. DKA triadı, hiperglisemi,
ketozis ve asidemidir. Tetikleyici faktörler olarak; yetersiz insülin
verilmesi, infeksiyon, periferik veya santral iskemik infarkt, ilaçlar ve
gebelik sayılabilir. Plazma glikoz seviyesi renal eşik değerini geçtiğinde
(yaklaşık 180 mg/dl) glikozüri ve ardından forse osmotik diürez olur. DKA
tedavisi ile patofizyolojik anormallik tersine çevrilir, insülin verilmesi ile
doku içine glikoz alımı artar ve serebral olmayan dokular tarafından glikojen
yapımı artar. DKAyı presipite eden nedeni bulup, tedavisi ve sıvı elektrolit
açığının replasmanı da yapılmalıdır. Hatırlanması gereken bir önemli nokta, çok
hızlı olarak plazma ozmolalitesinin normale getirilmesi ile serebral ödemin
gelişebileceğidir. Acile daha önce DM öyküsü olmayan, nedeni bilinmeyen koma ve
nöbetleri olan bir hasta getirildiğinde ayırıcı tanıda nonketotik hiperosmolar
koma düşünülmelidir. Hiperglisemi, hiperosmolalite ve bilinç bulanıklığı
ilerlemeden çok erken dönemde NKHyi tanımak ve tedavi etmek çok önemlidir.
Çünkü koma geliştikten sonra mortalite oranı sıklıkla dehidratasyon ve
infeksiyona bağlı olarak %50lere varır. NKHde olan nöbetleri önlemede AEİ
yetersiz kalır. Bazen NKHde nöbetlerin durdurulabilmesi için AEİ vermek
gerekebilir. Nöbetler (glikoz seviyesinin düzeltilmesiyle) durdurulamazsa, bu
nöbetlerin GABA eksikliği ile de ilişkili olabileceği hesaba katılarak
GABAerjik AEİnin (fenobarbital, benzodiazepinler, vigabatrin, valproat,
topiramat gibi) tercih edilmesi düşünülebilir.
Hiperosmolalite ile buna eşlik eden hipovolemi olduğunda bu
tablonun, mortalitesi DKAdan çok daha yüksektir. Kardiyak output ve kan
basıncı takibi tedavide öncelik verilmesi gereken hususlardır. Arteryel ve
Swan-Ganz kateteri takarak dolaşımın monitorizasyonu yapılmalıdır. Fazla
hacim yüklemesinden böylece kaçınılmış olur. Bu sendromun
gelişimindeki mekanizmada ketozun olmamasını açıklamak kolay değildir.
Patogenez
NKHnin yarattığı nöbetleri olan bazı kişilerde hiperosmolalite
gelişmez. Dolayısıyla nörolojik olayları yaratan faktörün hiperglisemi olması
daha büyük olasılıktır. Serum glikoz konsantrasyonunun
normale dönmesiyle semptomların düzelmesi de hipergliseminin rolü ile ilgili bu
görüşü desteklemektedir.
Yeni fokal iskemik lezyonlarda hiperglisemi epileptiform
aktiviteyi ve beyin ödemini, serebral korteksi tutan postiskemik durumlarda
arttırır. Hayvan deneylerinde oluşturulan hiperglisemide beynin gri maddesinde
oldukça sabit bir bölgesel kan akımı azalması vardır. Mekanizma kesin olmasa da
doku ödemine bağlı olarak vasküler direncin artması, viskozite artması veya
beyin hücrelerinde metabolizma hızının azalması olabilir. İnfarkt oluşturmaya
yetmeyen ve fakat fonksiyonları bozmaya yetecek derecede bir serebral iskeminin
ortaya çıkmış olması ve bu durumun fokal özellikleri yaratmış olması da
mümkündür. Hiperglisemi, GABAda azalmaya sebep olur: Krebs çemberi yoluyla
enerji üretiminin bozulmuş olmasını kompanse etmek üzere glutarik asid
dekarboksilaz aktivitesini azaltmakla GABA yapımını azaltır veya süksinik
semialdehit yolu aracılığı ile GABA kullanımını arttırır. GABA beynin önde
gelen inhibitör nörotransmitteri olduğundan kortekste inhibisyonun azalması ile
nöbetler ortaya çıkıyor olabilir. Nöbetlerin çoğu stimulus ya da hareketle
aktive edilebilir nöbetlerdir. Bazal gangliadaki GABA azalması ise NKHde
görülen hareket bozuklukları ile ilişkili olabilir.
Sonuç olarak GABA eksikliği bölgesel (yani vasküler) fonksiyon
bozukluğunu alevlendirip arttırabilir ve eğer serebral korteks primer olarak
tutulmuşsa fokal nöbetleri, subkortikal yapılar primer olarak tutulmuşsa diskineziler
ortaya çıkarabilir.
Tedavi
Hiperglisemi tedavisinde aşağıdaki beş yaklaşım
çok önemlidir.
1-
Sıvı alımının
arttırılması
2-
İntravenöz insülin
verilmesi
3-
Potasyum replasmanı
4-
Klinik ve temel
biyokimya parametrelerinin yakın takibi
5-
Tetikleyen nedenin
bulunup tedavi edilmesi
Tedavi komplikasyonları
DKA tedavisi ile
iyileşme olmasına rağmen hala mortalite olabilir. Hastaların büyük kısmı
kardiyovasküler sorunlar veya tetikleyen faktörler nedeniyle
kaybedilirler. Az sayıdaki hasta ise klinik ve laboratuvar olarak ilk
düzelmelerin olduğu dönemde beklenmedik şekilde kaybedilir. Postmortem beyinde
akut asfiksideki gibi lezyonların görüldüğü, perivasküler ve periselüler ödem
ile kapiller dilatasyon olduğu belirlenmiştir. Hızla gelişen intrakranial
basınç artışına bağlı bulgu ve belirtiler mortalitenin habercisidir.
DKAda beyin ödemine
bağlı intrakranial basınç artışı olur ve az sayıda hastada hızlı
nörolojik kötüleşme ve dolaşım kollapsı ile ölüme yol açabilir. İntrakranial
basınç artışı düşünülüyorsa, serebral ödem tedavi edilmelidir. Tedaviye rağmen
bu durum mortalitesi hala yüksek olan bir tablodur. Plazma şekerinin azaltılma
hız ve derecesi, mortalite için önemli bir risk faktörü değildir.
SU VE ELEKTROLİT METABOLİZMASI BOZUKLUKLARI
Başlangıçta, bilinç
durumunda değişiklikler ve epileptik nöbetlerle ortaya çıkar. Merkezi sinir
sistemi su ve elektrolit dengesizliğine karşı çok hassastır. Özellikle su
intoksikasyonuna bağlı beyin ödemi gelişmesi derhal semptom
verir. Çünkü kafatası içinde beynin genişleyeceği alan çok sınırlıdır.
Elektrolitlerin oynadığı rol; transmembran potansiyellerin idamesi,
nörotransmisyon, kalsiyum ve kalmodulinin içinde bulunduğu bazı metabolizma
reaksiyonları için de önemlidir.
Serum ve dolayısıyla tüm
vücuttaki osmolalite, susamayı, su-elektrolit dengesini kontrol eden
karmaşık nöroendokrin ve renal ilişkilerle düzenlenir. Serum osmolalitesi
arttığı zaman, beyin hacmi azalır. Serum osmolalitesi azaldığı zaman ise
beyinde şişme olur. Osmotik stres akut gelişirse, beyin hacim değişikliği
açısından çok az bir korunma yapabilir. Alttaki koruyucu mekanizma tam
bilinmemektedir. Deneysel çalışmalarda belli bir osmotik stres uygulandıktan
sonra beyinde bulunması gereken osmotik olarak aktif partiküllerin
hepsi tanımlanamamıştır. Bunlara da idyojenik osmol denir.
Hipoosmolalite ve Hiponatremi
Hemen her zaman hipo-osmolalite hiponatremi ile
birlikte görülür. Tanı laboratuvar incelemeleri ile konur.
Tablo 4. Hiponatremi nedenleri
|
Su ve sodyumun beraber eksikliği (hipovolemi) |
|
Böbrekten kayıp |
|
Primer böbrek hastalığı |
|
Osmotik diürez (glikoz, mannitol) |
|
Adrenal yetmezlik |
|
Böbrek dışı kayıp |
|
Gastrointestinal (diyare, kusma, serbest
drenaj) |
|
Transkütan kayıp (terleme, yanık) |
|
Sekestrasyon (asit, peritonit) |
|
Su kaybı olmaksızın hiponatremi |
|
Su ve sodyum retansiyonu ile ödem |
|
Dilüsyonel (iyatrojenik, psikojenik) |
|
Orak hücre sendromu |
|
Hiperosmotik (hiperglisemi veya mannitol verilmesi) |
|
Uygunsuz antidiüretik hormon sendromu |
|
Artefakt (laboratuvar hatası, hiperlipidemi ) |
Çok sayıda ve çeşitli
bir grup nörolojik hastalık, uygunsuz antidiüretik hormon sendromu (uygunsuz ADH sendromu) sonucu
hiponatremi ile ilişkilidir (Tablo 4 ve 5). Uygunsuz
ADH sendromu, normal veya artmış plazma volümü, normal
böbrek fonksiyonu olmasına karşın, ADHnin uygunsuz devamlı olarak
salınımı/etkisi nedeniyle oluşan hiponatremi ile karakterizedir. Bu sendrom asemptomatik olabilir ki, tek tedavisi sıvı
kısıtlamaktır. Ağır seyreden vakalarda hipertonik sıvılarla birlikte diüretik verilir.
Tedavinin çok hızlı bir şekilde yapılması hastada geri dönüşümü olmayan santral
pontin miyelinozise yol açabilir. Renal tübüllerde ADH etkisini ortadan
kaldıran tetrasiklin, demeklosiklin gibi çeşitli ilaçlar kronik sendromlarda başarılı şekilde kullanılmıştır. Subaraknoid
kanaması olan hastalarda, uygunsuz ADH sendromu
tanısını koyarken çok dikkatli olmak gerekmektedir. Subaraknoid kanaması olan
hastalarda hiponatremi ve kan hacminde azalma olması bunun gerçek uygunsuz ADH sendromu olduğunu göstermez. Ameliyat sırasında hafif semptomları olan fakat fark edilmeyen hasta postoperatif
dönemde ciddi ensefalopati tablosu geliştirebilir. Erkeklerde ve
postmenapozal kadınlarda postoperatif hiponatremi menstrüasyon gören kadınlara
göre az görülür. Solunum durması gibi komplikasyonlar
en çok menstrüasyondaki kadınlarda görülür. Genç bir kadın postoperatif dönemde
ensefalopati tablosunda ise değerlendirirken çok dikkatli olmak gereklidir.
Tablo 5. Uygunsuz ADH sendromu nedenleri
|
|
|
|
Malign neoplazmalar |
Akciğerin küçük hücreli karsinomu |
|
|
Pankreas |
|
|
Timoma |
|
|
Mezotelyoma |
|
|
Lenfoma (lenfosarkoma, retiküler hücre sarkomu, Hodgkin) |
|
|
Mesane, üreter, prostat |
|
|
Duodenum kanserleri |
|
|
Ewing sarkomu |
|
Merkezi sinir sistemi hastalıkları |
İnfeksiyonlar (menenjit, ensefalit, apse) |
|
|
Travma |
|
|
Subaraknoid kanama |
|
|
İnfarkt |
|
|
Guillain-Barré sendromu |
|
|
Akut intermittan porfiri |
|
|
Hidrosefali |
|
|
Neonatal hipoksi |
|
|
Shy-Drager sendromu |
|
|
Deliryum tremens |
|
|
Sistemik lupus eritematozus |
|
İlaçlar |
Vazopressin |
|
|
Oksitosin |
|
|
Vinka alkoidleri |
|
|
Tiyazidler |
|
|
Klorpropamid |
|
|
Fenotiyazin |
|
|
Karbamazepin |
|
|
Klofibrat |
|
|
Nikotin |
|
|
Monoamin oksidaz inhibitörü |
|
|
Trisiklik antidepresanlar |
|
|
Siklofosfamid |
|
|
Narkotikler |
|
Akciğer hastalıkları |
Tüberküloz |
|
|
Diğer pnömoniler |
|
|
Apse ve kavite |
|
|
Ampiyem |
|
|
Kistik fibrozis |
|
|
Obstrüktif hava yolu hastalığı |
|
|
Pnömotoraks |
|
|
Astma |
|
|
Pozitif basınçlı ventilasyon |
|
Diğerleri |
Hipotiroidizm |
|
|
Akut psikoz |
|
|
Postoperatif dönem |
|
|
İdyopatik |
Tedavide santral pontin miyelinozis
olasılığı düşünülerek, infüzyon plazma Na konsantrasyonunu
1 mmol/L/saat hızında arttırılacak şekilde yapılmalıdır. Serebral ödem veya
nöbet gibi komplikasyonlar varsa hiponatremi tedavisi
daha hızlı yapılabilir ve saatlik 4-5 mmol/Llik artışlar yapılabilir. Hasta
asemptomatik olduğunda, plazma Na değeri 120-125 mmol/L düzeyine yükselirse
veya plazma sodyumu 20 mmol/L düzeyinde artarsa hipertonik tuz tedavisi
kesilmelidir. Havayolu ve ventilasyon desteği gerekebilir. Henle halkasına etki
eden diüretiklerden örneğin furosemid kullanılabilir. Sık aralıklarla (her iki
saatte bir) elektrolitlerin takibi yapılmalı, hipernatremi oluşması
engellenmelidir.
Hiperosmolalite
Hipoosmolaliteden daha nadir görülür. Genellikle
hiperosmolalite yükselmiş Na değeri ile kendini gösteren bir laboratuvar
bulgusudur. Daha sık olarak DMlilerde hiperglisemi ile birlikte izlenir. Bu sendrom, sıklıkla ve özellikle sıcak iklimlerde
dehidratasyona bağlı olarak, ketozu olan veya olmayan kontrolsüz diyabetiklerde
ve daha az sıklıkla beyin bölgelerinin osmotik olarak santral lezyonlarla
uyarılması ile ortaya çıkar. Sıvı açığı aşağıdaki formül kullanılarak bulunur.
Sıvı açığı: 0.6 X[vücut
ağırlığı (kg)] X [ 1- 140/plazma Na değeri]
Örneğin 70 kg olan bir
hastada plazma Na değeri 150 mEq/L bulunursa sıvı açığı 2,8 L olur. Bu sıvı
açığının ilk yarısı hızlıca verilir, ikinci yarısı ise iyatrojenik beyin
ödemini önlemek için yavaş verilir. Hasta bu tedavi altında iken bilinç
değişikliği ve nöbetleri oluyorsa beyin ödeminin geliştiği düşünülmelidir.
Laboratuvar değerleri ve tedavi tekrar gözden geçirilmelidir.
Kalsiyum Metabolizması Bozuklukları
Hem hiperkalsemi hem de
hipokalsemi paratiroid bez hastalıklarından kaynaklanabileceği gibi başka
hastalıklarla da olabilir. Normal koşullarda total serum kalsiyumunun ½si
proteine, başlıca albümine bağlanır. Diğer yarısı iyonize formdadır ve bu tek
aktif formudur. İyonize formun konsantrasyonunda bir
kuşku olduğunda hipoalbüminemiye ve iyon sensitif elektrodlar ile iyonize
kalsiyuma tekrar bakılmalıdır.
Hiperkalsemi hiperparatiroidizm ile ilişkilidir. Granülomatöz hastalıklardan
özellikle sarkoidozda sıktır. Diüretik olarak tiyazid kullanımı, vitamin D,
kalsiyumun kendisi, kemiklere metastaz yapan tümörler (multipl miyelom, meme ve
akciğer kanseri) ve tiroid hastalıkları nedenlerden birkaçıdır. Birçok hastada
neden idyopatiktir. Hiperkalseminin bulgu ve semptomları
çeşitlilik gösterir. Ağır hiperkalsemi doğrudan beyni etkiler. Bu gruptaki
hastalarda metastatik tümör en çok multipl miyelom, meme ve akciğer kanseri
kaynaklıdır. Kanser hastaları gelişen hiperkalsemiye çok hassastırlar. Klinik
olarak, bilinç değişikliklerinden başlayıp psödodemans ve kuvvetsizlik gibi
çeşitli belirtiler verebilir. Gastrointestinal, renal ve kardiyovasküler
bulgular da olabilir.
Ağır hiperkalsemiler
yaşamı tehdit edicidir. Tedavinin başlangıcında diüretikler ve tuzlu
solüsyonlarla forse diürez yapılmalıdır. Gerekli olan tuzun hacmi fazla
olabileceği için santral venöz veya Swan-Ganz kateter tedavinin takibi için
gerekli olabilir. Yaşlılarda, kardiovasküler veya böbrek hastalığı olanlarda dahiliye ile birlikte hasta izlenmelidir. Acil tedavi
sonrası hiperkalseminin nedeni araştırılmalıdır.
Hipokalsemi
de genellikle
hipoparatiroidizme bağlı olarak ortaya çıkar. Sinir sisteminde artmış
eksitabilite nedeniyle nörolojik semptomlar görülür.
Ağızda ve parmaklarda paresteziler tetanik kasılmaya neden olan kramplar ve
birçok vakada epileptik nöbetler görülür (Şekil
4). Kronik hipokalsemide kafa içi basınç artması sonucu olan başağrısı,
kore veya parkinsonizm gibi ekstrapiramidal bulgular ile karşılaşılabilir.
Beyin tomografisinde bazal gangliada kalsifikasyon görülebilir.
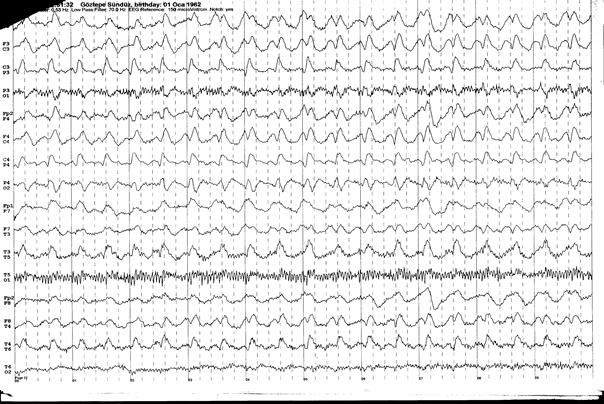
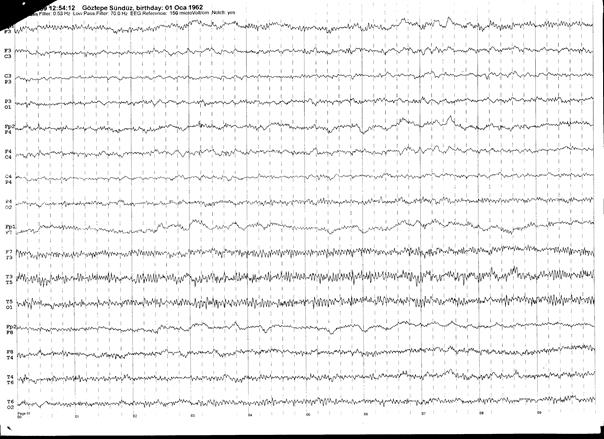
Şekil 4. 37 yaşında kadın hasta acil servise sağ fokal motor nöbetler ile getiriliyor. Hastanın sorulan sorulara yetersiz yanıt verdiği gözleniyor. Öyküsünde 6 yıl önce total tiroidektomi operasyonu mevcut ve hasta postoperatif takiplere gitmemiş. Rutin incelemelerinde hipokalsemi saptanan (Ca: 3.1mg/dL) hastanın EEG incelemesinde (üstteki trase) her iki hemisferde ritmik yavaş ve keskin yavaş dalgalar izlenmektedir. İntravenöz diazepam uygulaması sonrası EEGde deşarjlar kaybolmuştur (alttaki trase).
Klinik ve elektrofizyolojik olarak değerlendirildiğinde hasta nonkonvülzif status epileptikus olarak kabul edilmiştir ve etyolojide postoperatif hipoparatiroidizme sekonder hipokalsemi sorumlu bulunmuştur.
Fizik muayenede Chvostek ve Trousseau belirtileri
aranmalıdır. Katarakt ve papilödem izlenebilir. Ağır hipokalsemisi olanlarda
nöbetleri ve laringeal spazmları önlemek için kalsiyum infüzyonu yapılmalıdır.
Kronik tedavide kalsiyumun yanı sıra D vitamini de verilmelidir. Hiperkalsemi
ve hiperkalsiüri açısından dikkatli olunmalıdır.
Magnezyum Metabolizması Bozuklukları
Hipermagnezemi çok
nadirdir. Böbrek, magnezyum (Mg) homeostazını iyi ayarlayabilir. Eklampsisi
olan hastalara tedavi olarak verilen magnezyum hipermagnezemi yapabilir (Tablo
6). Magnezyum verilen hastanın böbrek hastalığı olup olmadığının bilinmesi
gereklidir. Hipokalsemi, artmış magnezyumun etkisini potansiyalize eder. Yaşamı
tehdit edici duruma gelebilir.
İzole hipomagnezemi de
nadir bir durumdur. Magnezyum desteği yetersiz olan uzun süreli parenteral
alimentasyon, malabsorpsiyon, alkolizm gibi magnezyumun diyetle eksik alımı,
hipomagnezemiye neden olabilir. Mg eksikliği genellikle karmaşık
elektrolit dengesizliğinin bir parçasıdır. Mg eksikliği; kişinin kalsiyumunu
günlük yeterli miktarda almasına rağmen serum kalsiyumu düşük bulunuyorsa
düşünülmelidir. Anoreksia, bulantı, Trousseau belirtisi, kuvvetsizlik, letarji
ve tremor gelişir. Magnezyumun yerine konması ile tablo derhal düzelir.
Tablo 6. Serum magnezyum düzeyi ve klinik bulgular
|
Mg seviyesi (mg/dl) |
Klinik bulgular |
|
1.5-2.5 |
Normal seviye |
|
4-8 |
Nöbeti önleyen terapötik düzey |
|
8-12 |
Patella refleksi kaybı, diplopi, sıcaklık hissi,
somnolans, dizartri |
|
15-17 |
Kas paralizisi, solunum sıkıntısı |
|
30-35 |
Kalp durması |
ANOKSİK VE İSKEMİK ENSEFALOPATİLER
En çok kardiyak durma, karbon monoksit zehirlenmesi
veya septik şok gibi olaylar sonrasında gelişir. Altta yatan nedene yönelik
acil müdahale ile merkezi sinir sistemi hasarı en az doku kaybı ile önlenmiş
olur. Hipoksi süreci dört alt grupta incelenir:
1-Yetersiz serebral kan akımı
2- Oksijen yeterliliğinin azalması
3- Kanda oksijen taşınmasının azalması
4-Oksijen kullanımının metabolik olarak
engellenmesi
Senkop ve Konfüzyonel Durum
Senkop, serebral iskemik
anoksinin kısa bir epizodu olarak değerlendirilebilir.
Hasta, çok kısa süreli bilinç kaybının ardından hemen kendine gelir. Kardiyak
outputtaki düşme uzun sürerse birkaç atımlık klonik hareket veya gerçek
jeneralize tonik-klonik nöbet olabilir. Senkop atağını nöbetten ayırmak her
zaman için kolay olmayabilir (Bakınız: Epizodik Bilinç Bozuklukları). Kısa hipoksik epizodun ardından
dakikalar veya saatler süren konfüzyon ve amnestik süreç olabilir.
Çoğunlukla anterograd amnezi haftalar sürebileceği gibi daimi de kalabilir.
Kognitif fonksiyonların korunup sadece amnezinin olduğu bu tablo selektif
olarak hippokampusun anoksik hasara uğradığını gösterir. Solunum yetmezliği,
yüksek rakımda bulunmak veya derin hipotansiyon gibi azalmış oksijen
yeterliliği veya sınırda olan serebral perfüzyonun bozulması,
veya her ikisi birden, hafif kognitif değişiklikler yapar ve konfüzyona kadar
ilerleyebilir. Bu tablo çok ağır ve uzun süreli olursa uyanıklığın
dalgalanması, halüsinasyonlar ve delüzyon ile tipik
deliryum belirtileri görülebilir.
Akut dağ hastalığında; başağrısı, halsizlik, anoreksia ve
bulantı olur. Bu, hafif serebral ödeme bağlı olarak gelişir. Ventilasyonun
supresyonu ve sedasyon yapıcı ilaçlar (etanol alımı gibi) bu bulguları daha da
arttırır. Tedavi olarak asetazolamid, kortikosteroid ve oksijen verilir. İnme
riski olanlar için yüksek rakımlarda bulunmak tehlikeli olabilir. Daha önce
asemptomatik intrakranial kitlesi olanlarda semptomlar
ortaya çıkabilir.
Fokal Serebral İskemi
Deliryum veya bilinç
düzeyinin bozukluğu ile birlikte uzun süreli hipotansif kalan kişide serebral
infarkt oluşabilir. İnfarktın perfüzyon basıncının yetersizliğine bağlı olarak
arterlerin watershed zonlarında veya uç arteryol bölgesinde oluştuğu
görülür.
Postanoksik Koma
Uzun süreli bilinç
değişikliği ve yaygın serebral hasara yol açan anoksi için gerekli olan spesifik süre bilinmemektedir. Kişiden kişiye değişebilir.
Kalp durması öncesi glikoz seviyesi, preiskemik ilaç alımı (aspirin,
veya kalsiyum kanal blokeri) beraberinde hipotermi (soğuk suda boğulma veya çığ
altında kalma) olup olmaması önemli olabilir. Küçük çocuklar nispeten anoksik
hasara daha dirençlidirler. Resüsitasyon sonrası ağır anoksiden geçmiş bir kişi
de derin komadadır ve genellikle geçici olarak beyinsapı cevabı, ışık refleksi
bile görülmez. Hayatta kalanlar 1-3 saat içinde beyinsapı fonksiyonlarını geri
kazanırlar, fakat genellikle solunum desteğine ihtiyaç duyarlar. İlk önceleri
flask bulgular varken deserebre veya dekortike olurlar. İlk günlerde her 3
hastadan birisi değişik tipte nöbet geçirmeye başlarlar. Aksiyal miyoklonus en
şiddetli olanıdır ki mekanik ventilasyona engel olur. Geçirilen nöbetler
kardiyak yükü arttırır ve beraberindeki nöbete bağlı hipertermi ve artmış
serebral metabolik talep serebral iyileşme şansını giderek azaltır. Asenkron
distal miyoklonus da görülebilir. Nöbetler toksik veya metabolik (aminofilin
intoksikasyonu, lidokain intoksikasyonu, azotemi, veya
hiponatremi) nedenlere de bağlı olabilir.
Geç dönemde bir miktar
serebral iyileşme ile fokal nöbetler başlayabilir. Ağız kenarında hafif
çekilmeler, nistagmoid göz hareketi gibi klinik bulgular nonkonvülzif status
epileptikus açısından araştırmayı gerektirir. Postanoksik stuporu veya konfüzyonel
tablosu uzamış kişide klinik planda olmasa da elektrofizyolojik status
epileptikus düşünülmeli ve EEG tekrarları yapılmalıdır.
Diğer Sekeller
Kognitif fonksiyonların
geri kazanımı anoksik hasarlanmadan sonraki ilk haftalarda hızlıca olur.
Sonraki 3 aylık dönemde plato çizer. Orta ve ağır biparietal defisit
(diskalküli, dispraksi), her üç hastadan birinde görülür. Yaklaşık yarısında
orta ve ağır bellek kusuru kalır. Planlama ve organizasyon becerisi bozulur,
fakat konuşma bozukluğu daha az rastlanan bir bulgudur. Ağır hipoksik olaydan
geçmiş kişilerde iyileşirken sıklıkla hareket bozuklukları görülür. Bilateral
hemiparezi, psödobulber paralizi, parkinsonizm, tremor, koreoatetoz ve distoni
izlenebilir. Anoksiden geçmiş olgularda özel bir sendrom
(Lance-Adams sendromu) dışında epilepsi nadirdir. Anoksik iskemik
ensefalopatiden iyi kognitif iyileşme gösteren hastalarda geç başlangıçlı ve
ciddi şekilde yaşamını etkileyecek miyokloniler olur. Distal ekstremitelerde
dirençli, stimulus ve aksiyona duyarlı, asenkron miyokloniler izlenir. Bu tablo
günler ve haftalar içinde çıkar ve yıllar içinde sıklıkla iyileşme gösterir.
Klonazepam, valproik asit ve pirasetam etkili olabilir.
Kalp ve Solunum Durmasından Sonra Anoksik
Komanın Prognozu
Ağır anoksik hasarlanmanın
en çok rastlanan nedeni kalp ve solunum durmasıdır. Buna bağlı mortalite ve
morbidite yüksektir (Tablo 7 ve 8). Hastaneye gelinceye
kadarki dönemde mortalite %54-88, ilk bir yıl içinde %20, üç yıl içinde
%40tır. Geri kalanının %75inde ağır sekel nörolojik bulgular ve ağır bellek
kusurları vardır.
Tablo 7. Kalp ve solunum durması sonrası prognozu belirleyen bulgular
|
SÜRE |
KÖTÜ |
İYİ |
|
İlk muayene |
Işık refleksi yok |
Işık refleksi var, spontan göz hareketi var, dekortike
veya deserebre postürde |
|
Birinci gün |
En iyi bulgu dekortike postür, spontan göz hareketi yok |
Motor harekette belirgin düzelme, spontan veya gürültüye
göz açma hareketi var |
|
Üçüncü gün |
Aynı tablo |
Motor hareket iyi, spontan göz açma var |
|
Birinci hafta |
Aynı tablo, emirlere uymuyor |
Emirleri yerine getiriyor |
Tablo 8 Kalp ve solunum durması sonrası kranial
refleksler ile yaşam yüzdesi arasındaki ilişki
|
SÜRE |
KRANİAL REFLEKS ANOMALİSİ* |
YAŞAM YÜZDESİ (%) |
|
< 3 SAAT |
0 1 2 3 |
80 46 29 0 |
|
< 6 SAAT |
0 1 2 3 |
80 37 27 0 |
|
< 24 SAAT |
0 1 2 3 |
81 38 21 0 |
|
< 24-48 SAAT |
0 1 2 3 |
76 21 0 0 |
* Bakılan kranial refleksler: kornea refleksi,
spontan konjuge bakış, ışık refleksi.
Olmayan reflekslerin adedi kadar puan
verilmiştir.
Elektroensefalografi
(EEG): Kalp ve solunum durması sonrasında ilk
saniyelerde EEGde değişiklik yoktur. 14-18. saniyelerde yüksek amplitüdlü
jeneralize yavaş dalgalar görülmüştür. Kalp durması kısa sürmüşse 5-12 saniye
içinde EEGdeki bulguların geri döndüğü bilinmektedir. Ancak kalp durması
sonrası serebral hasarlanması olan kişide tipik yaygın patolojik EEG bulguları
olur. Kalp durması sonrası EEG bulguları prognoz açısından sınıflandırılmıştır:
Evre 1: Normal sınırlar içinde; tümüyle alfa
ritmi veya alfa ritmine karışan nadir teta frekansında yavaş dalgalar
Evre 2: Hafif bozukluk; teta aktivitesine
eklenmiş nadir alfa veya bazen delta aktivitesi
Evre 3: Orta derecede bozukluk; başlıca delta
veya delta ile teta veya deltaya karışan nadir alfa veya paroksismal
keskin deşarjlar
Evre 4: Ağır bozukluk; yaygın delta veya
periyodik keskin dalga deşarjları veya izoelektrik dönemlerle ayrılan kompleksler (boşalım-baskılanım)
Evre 5: Çok ağır bozukluk; hemen hemen düz çizgi
halinde kayıt veya izoelektrik kayıt
En iyi prognozu olan Evre 1 iken Evre 4-5
ölümcül seyirlidir.
Anoksik iskemik hasarlanma veya ilaç
intoksikasyonundan sonra EEGde alfa koma görülebilir. Bu
durum, gözün açılması veya diğer stimulasyonlara cevapsız yaygın alfa
aktivitesi (8-12 Hz) izlenmesidir.
Uyandırılmış Potansiyel
Çalışmaları: Anoksik iskemik
ensefalopatili hastalarda somatosensoryel uyandırılmış potansiyellerde (SEP)
erken kortikal kompleks (N20-P27) kaybı prognozun kötü
olduğunu gösterir. Klinik, EEG, ve SEP beraber
yapıldığı zaman daha duyarlı bir şekilde prognoz hakkında yorum yapılabilir. Bu
elektrofizyolojik yöntemleri kullanırken hem yorumlama hem de teknik uygulama
açısından deneyime ihtiyaç vardır. Çünkü yoğun bakım ünitelerinde çevredeki
artefaktları yok etmek sıklıkla çok zordur (Ayrıca bakınız: Uyandırılmış Potansiyeller).
Tedavi
Kalp ve solunum durması
nedenli anoksik iskemik ensefalopati yüksek mortalite ve morbiditeye yol açar. Stabil
veya iyileşme gösteren grubunda ise sıklıkla nöbetler ortaya çıkar. Uzun süreli
hastalık döneminde sepsis ve ilaç etkisi gibi nedenlerden dolayı tanısı daha
güçleşir. Tanı amacıyla lomber ponksiyon, görüntüleme, EEG tetkikleri
yapılmalıdır. Hipotermi tedavisi olarak vücut ısısının 36 °C düzeyinde tutulmasının, daha önce söylenen
değerler olan 32-34 °C kadar etkili olduğu gösterilmiştir. Soğutma işlemi için özel
donanım gerekmektedir. Anoksik komanın komplikasyonlarından
tüm organlar etkilenebilir. Sıvı ve elektrolit takibi iyi yapılmalıdır. Stres
ülserine karşı koruyucu tedavi verilmelidir. Beslenme açısından diyetin
ayarlanması, genel vücut bakımı, ağız-diş bakımı, genital bölgenin bakımı,
nazogastrik veya idrar sondası varsa bunların bakımı ve zamanında
değiştirilmesi gereklidir. Dekübitus ülserlerini önlemek için havalı yatak ve
beraberinde hastanın iki saatte bir çevrilmesi üzerinde durulması gereken
noktalardır Ateş, nabız, tansiyon, aldığı çıkardığı sıvı miktarının takibi
önemlidir. Bunun dışında başka özel bir tedavisi yoktur.
KAYNAKLAR
1. Bradley WG, Daroff RB, Fenichel GM, Marsden
CD. Neurology in Clinical Practice: The Neurological Disorders Vol II, Third
edition, Butterworth Heinemann, USA, 2000.
2. Burn DJ, Bates D. Neurology and kidney. J Neurol Neurosurg
Psychiatry 1998;65:810-821.
3. Brenner RP. The electroencephalogram in altered states of
consciousness. Neurologic Clinics 3, 1985.
4. Butterworth RF.
Pathogenesis of the hepatic encephalopathy and brain edema in acute liver
failure. J Clin Exp Hepatol 2015; 5 supp 1:S96-103.
5. Niedermeyer E. Metabolic central nervous
system disorders.İçinde: Electroencephalography: Basic
Principles, Clinical Application and Related Fields. Eds: Niedermeyer E &
Lopes Da Silva. Williams& Wilkins, 7th edition, USA, 2017.
6. Messina Z, Mills R. Anoxic encephalopathy.
Stat Pearls (internet) 2019.
7. Pujol J, Kulisevsky J, Moreno A ve ark.
Neurospectroscopic alterations and globus pallidus hyperintensity as related MR
markers of reversible hepatic encephalopathy. Neurology 1996;47:1526-1530.
8. Raskin NH, Fishman RA, Neurological disorders
in renal failure, New Eng J Med 1976;294:143-148.
9. Bass NM, Mullen KD, Sanyal A,
ve ark. Rifaximin treatment in hepatic encephalopathy. N Engl J Med 2010,
362:1071-1081.
10. Martin P, DiMartini A, Feng S, ve ark. Evaluation for liver transplantation in adults:
2013 pratice guideline by the American Association for the study of liver
diseases and the American Society of Transplantation. Hepatology 2014;59:1144-1165.
11. Seifter JL, Samuels
MA. Uremic encephalopathy and other brain disorders associated with renal
failure. Semin Neurol 2011;31:139-143.