Sinir Sistemi İnfeksiyonları
Yazanlar: Elif Kocasoy Orhan, Arman Çakar, Gülşen Akman-Demir
Son Güncelleştirme Tarihi: 29.06. 2020
GİRİŞ
Merkezi sinir sistemi (MSS) infeksiyonları acil hekimlikte çok önemli bir grubu oluşturur. Çok hızlı tanı ve tedavi yaklaşımı gerektirir, çoğu zaman tedavi ile tam düzelme sağlanabilirken, tedavinin gecikmesi veya tedavi edilmeme durumunda yüksek mortalite veya kalıcı nörolojik hasar söz konusudur. Bu nedenle her hekimin MSS infeksiyonlarını tanımayı ve tedavi etmeyi çok iyi bilmesi gereklidir.
Merkezi sinir sisteminin iki önemli özelliği, burada ortaya çıkan infeksiyonların seyri ve sonuçlarını belirlemektedir:
1. MSSnin anatomik yapısı: Gerek dural kese, gerekse onu da çevreleyen kemik yapı, MSSyi katı bir zırh gibi sararak içinde yer alan dokularda genişlemeye izin vermez. Bu nedenle gerek doğrudan sıkışma ile gerekse vasküler yapıların basıya uğraması ile infekte bölgede ve komşu MSS yapılarında oldukça kısa bir süre içinde kalıcı hasar meydana gelebilir.
2. MSSnin immünolojik yapısı: MSS immünolojik olarak görece korunmuş bir bölgedir. Bu immünolojik ayrıcalığı sağlayan 3 ana faktör vardır:
a) kan beyin bariyeri: normal koşullarda bazı eriyebilir moleküller dışında hiçbir molekülün (yüksek molekül ağırlıklı proteinler, immünglobulinler, kompleman sisteminin elemanları, sitokinler, vs.) veya hücrenin sistemik dolaşımdan MSS içine geçmesine izin vermez.
b) sınırlı lenfatik drenaj: uzun yıllar MSSnin bir lenfatik drenajının olmadığı düşünülmüştür, bugün ise servikal lenf düğümlerine sınırlı da olsa bir drenaj bulunduğu bilinmektedir.
Ayrıca klasik lenfatik dolaşımdan yoksun olan MSSnin sıvı dengesi ve interstisyel atıkların giderilmesine yönelik olarak glimfatik sisteme sahip olduğundan bahsedilebilir. Demanstan beyin ödemine kadar birçok nörolojik tutulumda güncel bir araştırma alanı olan glimfatik sistemin özellikle yüksek molekül ağırlıklı proteinler gibi BOSta dolaşan ve çözünen maddelerin regülasyonunda önemli rol oynadığı düşünülmektedir. Kısacası glimfatik sistem astroglial hücreler tarafından oluşturulan, çözünebilir protein ve metabolitlerin MSSden atılımını sağlayan ve yeni keşfedilen bir atık temizleme sistemidir.
c) yetersiz antijen sunumu: antijen sunumu için gerekli bazı moleküllerin (MHC tip I ve tip II antijenleri, gibi) normal koşullarda MSS hücreleri tarafından sergilenmemesi de MSSnin immünolojik açıdan korunmuş bir bölge olmasına katkıda bulunur.
Aslında yukarıda sayılan gerek anatomik gerekse immünolojik özellikler başlangıçta MSSyi koruyucu bir işlev gösterirler. Ancak bu koruyucu işlevin yetersiz kaldığı durumlarda infeksiyon meydana gelir. Bu durumda bütün bu koruyucu faktörlerin infeksiyonla savaşta MSSyi güçsüz kılacağı da açıktır. Bu nedenlerle, MSS infeksiyonlarında erken tanı ve tedavi çok büyük önem taşımaktadır.
İnfeksiyon ajanlarının MSSye varış yolları
1. Hematojen yol: vücuttaki başka bir infeksiyon odağından kana karışan ajanın beyin parenkimine veya meninkslere ulaşması;
2. Komşuluk yolu: paranazal sinüsler, orta kulak, mastoid ve orbita infeksiyonları gibi baş boyun bölgesindeki komşu yapıların infeksiyonlarının MSS yapılarına ulaşması;
3. MSS koruyucu tabakasının bütünlüğünün bozulması: travma, cerrahi girişim, konjenital anomaliler nedeni ile MSSyi çevreleyen kemik ve zar yapıların bütünlüğünün bozulması;
4. Nöral yol: infeksiyon ajanının (özellikle bazı virüsler) vücuda giriş yerinden periferik sinirler içinde MSSye ulaşması.
MSS infeksiyonlarında görülebilen klinik tablolar
Genel olarak MSS infeksiyonlarının 5 ana belirtisi vardır (Tablo 1). Ancak asıl tutulan bölgenin özelliğine göre bu belirtilerin bir kısmı daha ön planda bir kısmı daha geri planda olabilir. Klinik tablolar 4 başlıkta toplanabilir:
1. Menenjit: (meninkslerin iltihabı) -Ateş ve halsizlik gibi genel infeksiyon belirtilerinin yanı sıra, şiddetli başağrısı, bulantı-kusma, ense sertliği ve diğer meningeal iritasyon bulguları (Kernig, Brudzinski bulguları) ortaya çıkar. İlerleyen dönemde uyanıklık kusuru gelişebilir. Çok daha seyrek olarak epileptik nöbetler, fokal nörolojik bulgular, kranial sinir felçleri görülebilir.
2. Ensefalit: (beyin parenkiminin iltihabı) -Fokal nörolojik bulgular, davranış değişikliği, epileptik nöbetler ve giderek artan uyanıklık kusuru sıktır. Yüksek ateş, başağrısı, bulantı-kusma olabilirse de ense sertliği ve diğer meningeal iritasyon bulguları yoktur ya da geri plandadır.
3. Apse: (beyin parenkiminin çevresi sınırlandırılmış iltihabı) -Fokal nörolojik bulgular, epileptik nöbetler, başağrısı, bulantı-kusma ve giderek artan uyanıklık kusuru olur. Ateş, olabilirse de ense sertliği ve diğer meningeal iritasyon bulguları yoktur ya da geri plandadır. Epidural veya subdural ampiyem, infeksiyonun bu boşluklarda sınırlanmış şeklidir ve benzer bulgular verir.
4. Vaskülit/filebit: (vasküler yapıların iltihabı) -Genellikle menenjit komplikasyonu olarak ortaya çıkar. Etkilenen vasküler yapıya göre ya arter tıkanma sendromları-iskemik inme ya da dural sinüs trombozuna (klinikte başağrısı, kafa içi basınç artışı sendromu [KİBAS], fokal nörolojik bulgular) benzer tablolarla karşımıza gelir.
Tablo
1. MSS
infeksiyonlarının 5 ana belirtisi
1. Ateş
2. Başağrısı/bulantı-kusma
3. Ense sertliği ve meningeal iritasyon bulguları
4. Mental durum değişikliği/kafa karışıklığı
5. Fokal nörolojik bulgular/ epileptik nöbetler
Bakteriyel İnfeksiyonlar
Akut Bakteriyel (Pürülan) Menenjit
Akut bakteriyel menenjitler, dünyanın her bölgesinde, her yaşta görülebilen ve yaşamı tehdit eden ciddi infeksiyon hastalıklarının başında gelmektedir. Mortalite ve morbiditesi yüksek olan bu grup hastalık için 2013 yılında yapılan bir hesaplamaya göre yılda 16 milyon akut bakteriyel menenjit olgusu görülmektedir. Özellikle çocukluk ve ileri yaşta pik insidansına ulaşmaktadır. En sık etkenlere karşı aşı geliştirilmesine karşın halen acil tanı ve tedavi yaklaşımı gerektiren bir durumdur.
Etyoloji
Bakteriyel menenjit etkeni, meninkslere çoğu zaman kan yolu ile (septisemi sırasında veya septik emboli ile), daha seyrek olarak da komşuluk yolu ile ulaşır. Her türlü patojen bakteri menenjite yol açabilirse de, bazı ajanlar sıklık açısından önde gelirler. Yaşla ve hastanın bağışıklık sisteminin durumu ile değişmekle beraber, erişkinlerde pürülan menenjit etkeni olarak karşımıza en sık çıkan bakteriler Haemophilus influenzae, Neisseria meningitidis (meningokok) ve Streptococcus pneumoniaedir (pnömokok). Bu üç ajan bakteriyel menenjitlerin yaklaşık üçte ikisinin etkenidir ve aşılama ile önlenebilir olması önemlidir. Bunlardan başka, Listeria monocytogenes ve gram negatif çomaklarla giderek daha sık karşılaşılmaya başlanmıştır. Diğer ajanlar ise normal koşullarda seyrek olarak bakteriyel menenjit etkeni olarak karşımıza çıkar; ancak aşağıda sıralanan bazı özel durumlarda bunlar akla gelmelidir (Tablo 2 ve 3).
Tablo 2. Akut bakteriyel menenjitte en sık karşılaşılan infeksiyöz ajanlar (Kaynak 3ten alınmıştır)
|
Bağışıklık sistemi sağlam hastalar |
||
|
Yaş: |
Neonatal |
E. coli (% 50-60), B grubu streptokoklar (% 20-50) |
|
|
Çocuklar |
H. influenzae (% 40-60) N. meningitidis (% 25-40) |
|
|
Erişkinler |
S. pneumoniae (% 30-50) N. meningitidis (% 10-35) |
|
|
Yaşlılar |
Gram negatif çomaklar S. pneumoniae L. monocytogenes |
|
Cerrahi girişim: |
Gram negatif çomaklar S. aureus |
|
|
Travma: |
S. pneumoniae H. influenza S. aureus |
|
|
Bağışıklık sistemi bozukluğu bulunan hastalar |
||
|
T-hücre/makrofaj defekti |
L. monocytogenes Kriptokok |
|
|
Nötropeni |
Enterobakteriler P.aureoginosa Kandida |
|
|
Dalak işlev bozukluğu |
S. pneumoniae |
|
Tablo 3. Akut bakteriyel menenjitte en sık karşılaşılan infeksiyöz ajanlar (%) (Kaynak 3ten alınmıştır).
|
Ajan |
Yenidoğan (<1 ay) |
Çocuk (1 ay-15 yaş) |
Erişkin (>15 yaş) |
|
H. influenzae |
0-3 |
40-60 |
1-3 |
|
S. pneumoniae (pnömokok) |
0-5 |
10-20 |
30-50 |
|
N. meningitidis (meningokok) |
0-1 |
25-40 |
10-35 |
|
Gram negatif çomaklar |
50-60 |
1-2 |
1-10 |
|
Streptokoklar |
20-50* |
2-4 |
5 |
|
Stafilokoklar |
5 |
1-2 |
1-15 |
|
Listeria monocytogenes |
2-10 |
1-2 |
5 |
*Hemen daima B grubu streptokoklar
Patoloji
İnfeksiyon ajanı meninkslere genellikle hematojen yolla ulaşır. Daha seyrek olarak komşuluk yolu ile veya MSS koruyucu tabakasının bütünlüğünün bozulmasına bağlı olarak gelişebilir. Erken dönemde meninks damarlarında hiperemi görülür; kısa süre sonra önce nötrofiller, ardından da lenfositler subaraknoid aralığa gelir. Bu arada kan-beyin bariyerinin bütünlüğünün bozulması ile fibrinojen ve diğer serum proteinleri subaraknoid aralığa sızar. Uygun zamanda yapılan BOS incelemesinde nötrofilden zengin bir hücre profili ile yüksek protein değeri saptanacaktır. Bu aşamada eğer tedavi edilmezse menenjit komplikasyonları gelişebilir. Bunlar arasında BOS dolaşımının bozulmasına bağlı hidrosefali ve herniasyon, venöz veya arteriyel trombozlar (inme benzeri tablolar), kronik araknoidite bağlı kranial sinir felçleri ve/veya miyelopati yer alabilir.
Klinik ve Laboratuvar Bulguları
Genel olarak bütün etkenler benzer bir klinik tabloya yol açar, spesifik, ayırt ettirici klinik bulguları yoktur. Saatler-günler içinde giderek şiddetlenen başağrısı, yüksek ateş, bulantı-kusma görülür. Nörolojik muayenede ense sertliği ve diğer meningeal iritasyon bulguları saptanır. Daha seyrek olarak epileptik nöbetler, fokal nörolojik bulgular görülebilir. Tanıda BOS bulgularının önemi büyüktür. Ancak bazı durumlarda lomber ponksiyon yapılması kontrendikedir. Eğer fokal bulgular ve/veya nöbetler varsa, papilla ödemi saptanırsa mutlaka öncesinde kranial BT (veya MR) incelemesi yapılmalıdır. Tetkiklerin yapılması eğer tedaviyi geciktirecekse öncelikle ampirik tedaviye başlanmalıdır (Tablo 4).
Tablo 4. Görüntüleme yapılmadan lomber ponksiyon (LP) yapılmasının kontrendike olduğu durumlar*.
1. Papilla ödemi
2. Epileptik nöbet
3. Fokal bulgular
4. Uyanıklık kusuru
*Bu durumlarda LP öncesinde mutlaka kranial BT veya MR yapılarak olası bir yer kaplayıcı lezyon dışlanmalıdır. Görüntüleme yapılması tedaviyi geciktirecekse, hasta menenjit gibi kabul edilip ilk tedavisine başlanmalı, ondan sonra görüntüleme yöntemlerine başvurulmalıdır.
Genellikle akut bakteriyel menenjitte spesifik bir görüntüleme bulgusu yoktur, BT veya MR normaldir. Eğer ödem gelişmeye başlamışsa beyinsapı çevresindeki sisternalar görünmeyebilir. Meninkslerde kontrast tutulumu görülebilir. Nöroradyolojik incelemeler ayrıca geç dönemde komplikasyonların ortaya konmasında yararlı olabilir. Ayrıca, özellikle muayenesinde dilate fiks pupilleri olan komadaki hastalar ile gözleri belli bir yöne deviasyon gösteren ve okülosefalik refleksi alınamayan, papilödemi olan, deserebre ya da dekortike postürde olan, hemiparezi, hipertansiyon ve bradikardi bulgusu olan hastaların ciddi herniasyon riski olabileceği hatırlanmalı ve mutlaka görüntüleme yapılmalıdır.
Menenjit tanısında asıl yol gösterici olan laboratuvar incelemesi BOS analizidir. Lomber ponksiyon mümkün olan en ince iğne ile (erişkinde 22 gauge) yapılmalı ve 5-8 mlden fazla BOS alınmamalıdır. Menenjit KİBASa yol açan bir tablo olduğundan BOS basıncı yüksektir (>200 mmH2O), normalde renksiz ve berrak olan BOS, pürülan menenjitte grimsi beyaz ve bulanık, boza kıvamındadır. Herhangi bir antibiyotik tedavisi almamış olan hastada mm3te 1000-10000 arasında lökosit bulunur. Erken dönemde lökositlerin %85-95ini nötrofiller oluşturur, ama günler geçtikçe lenfositlerin oranı artar. Kısmen tedavi edilmiş-iyi tedavi edil(e)memiş olan menenjitte de lenfositler baskın hale geçer, bu durumda hücre sayısı çok değişken olabilir. Akut bakteriyel menenjitte BOS protein düzeyi de hemen daima yüksektir (genellikle 100-500 mg/dl). BOS şekeri genellikle azalmıştır (< kan şekerinin %40ı veya <40mg/dl). Bakılabilirse BOSta CRP düzeyinin yükselmiş olması bakteriyel menenjit tanısını destekler. Gram boyama ile pnömokoklar ve H. influenzae gösterilebilir; meningokoklar ise daha zor görülür. BOS ve kan kültürü yapılabilirse etken ortaya konabilir; ancak bu zaman alıcı bir işlemdir. Tedaviye başlanması için etkenin ortaya konması beklenmez. Buna karşılık, serolojik yöntemlerle bakteriyel antijenin ortaya konması hem hızlı sonuç verir hem de hasta antibiyotik almış olsa da sonucu etkilemez.
Epidemiyoloji ve Klinik Tablolar
Gram negatif bir kokobasil olan H. influenzae, 2 ay-5 yaş arası çocuklarda en sık görülen menenjit etkenidir. Daha sonra ilerleyen yaşla birlikte sıklığı giderek azalır. Yıl içinde ilkbahar ve sonbahar aylarında artış gösterir. Özellikle 1990ların başlarında bebeklerde 2. aydan itibaren yaygın olarak aşı uygulamasının başlatılmasından sonra H. influenzae menenjiti sıklığının giderek azalmaya başladığı dikkati çekmekte ise de, özellikle gelişmekte olan ülkelerde çocuklarda en önde gelen menenjit etkenidir. H. influenzae erişkinlerde ancak paranazal infeksiyonlara sekonder gelişen veya kafa travması/BOS rinoresi ile ilişkili menenjitlerde rol oynar. Bu nedenle büyük çocuklarda veya erişkinlerde menenjit etkeni olarak H. influenzae saptanmışsa bu tür kronik infeksiyonlar, BOS fistülü veya bağışıklık sistemini bozan bazı durumlar (diyabet, alkolizm, vs.) araştırılmalıdır.
Erişkinlerde en sık görülen menenjit etkeni gram pozitif kok olan Streptococcus pneumoniaedir. Ancak, pnömokokların çocuklarda da sıklıkla menenjit etkeni olarak karşımıza çıkabileceği unutulmamalıdır. Tahmini hesaplamalara göre Türkiyede pnömokoklara bağlı yılda yaklaşık 250 menenjit, 250.000 pnömoni, 2.500.000 otit tanısı alan çocuk hastadan bahsedilebilir. Özellikle H. influenzae aşısı uygulamasının başlatılmasından sonra çocuklarda pnömokok menenjiti oranı giderek artmaktadır. Ülkemizde 2008 yılından bu yana Sağlık Bakanlığı tarafından yayınlanan Genişletilmiş Bağışıklama Programı Genelgesi ile pnömokok aşısı ulusal aşılama takvimine dahil edilmiş, 2011 yılında da daha fazla serotipi içeren yeni aşı uygulamaya eklenmiştir. Ayrıca pnömokok menenjiti olan hastaların yaklaşık dörtte birinde otit ve mastoidit bulunabildiği, yine bir diğer dörtte birinde de pnömoni bulunabildiği unutulmamalıdır. İnvazif pnömokok infeksiyonu olan kişilerde humoral immünite bozukluğu bulunabileceği de hatırlanmalıdır. Özellikle splenektomi, diyabet, alkolizm, karaciğer hastalığı ve HIV infeksiyonu araştırılmalıdır. Pnömokoklara bağlı menenjitlerde erken dönemde nöbetler ve uyanıklık kusuru daha sık görülür.
Gram negatif diplokoklar şeklinde görülen meningokoklar da hem çocuklarda hem erişkinlerde menenjit etkeni olabilir. Özellikle Asya ve Afrikada yaygın salgınlara yol açabilir. Yaş ilerledikçe meningokok infeksiyonu sıklığı azalır. Çocuk ve erişkinlerde kullanılabilen farklı özelliklere sahip aşılar ülkemizde de uygulanmaktadır. Klinik olarak diğer menenjit etkenlerine benzer bir tablo yaratır, ancak olguların yaklaşık yarısında gövde ve alt ekstremitelerde başlangıçta maküler daha sonra peteşiyal karakterde döküntüler görülür. Meningokok sepsisi söz konusu ise yaygın-disemine intravasküler koagülopati (DIC) gelişir ve yaygın purpura (purpura fulminans) görülür; yüksek mortalite işareti olan bu durum ekstremite uçlarında nekroza yol açabilir. Meningokok menenjitinin mortalite ve morbiditesi yüksek olup, ateş ve döküntüsü-peteşileri olan her hastanın meningokoksemi olarak kabul edilerek tetkik ve tedavi edilmesi önerilmektedir.
Diğer ajanlardan B grubu streptokoklar neonatal menenjit etkenidir ve yaşamın ilk günlerinde ortaya çıkar. İnfeksiyon etkeni genellikle doğum kanalından geçiş sırasında bulaşır. Risk faktörleri arasında prematüre veya düşük tartılı bebek, zarların erken açılması ve maternal B grubu streptokok bakteriürisi sayılabilir. Erişkinlerde MSS infeksiyonu ajanı olarak çok seyrek karşımıza çıkar. Genellikle gebelikte amnion sıvısı infeksiyonu şeklinde görülür ve menenjit gelişimi nadirdir. Ayrıca gebelik dışında, ileri yaş, diyabet, siroz ve sistemik malignite gibi risk faktörleri olan hastalarda görülebilir.
Gram pozitif çomak olan Listeria ise görece seyrek bir menenjit etkenidir. Yiyecekler yolu ile bulaşır. Risk faktörleri arasında ileri yaş, gebelik, diyabet, immünsupresyon (malignite, böbrek yetersizliği, HIV infeksiyonu, transplantasyon, steroid tedavisi veya kemoterapi) sayılabilir. Yenidoğanlarda da menenjit etkeni olabilir (maternal infeksiyona bağlı olarak gelişir). Listeria menenjiti klinik olarak diğer menenjitlere benzer ancak epileptik nöbetler sıktır ve beyinde veya beyinsapı parenkiminde mikro-apselere yol açarak farklı nörolojik bulgular verebilir. Ayrıca, BOStaki hücre sayısı daha azdır, nötrofil oranı ve protein düzeyi de daha azdır. Lenfositten daha zengin BOS hücre profili saptanabilir.
Yetersiz tedavi edilmiş (iyi tedavi edil(e)memiş) menenjit kavramı
Bu terim, karşımıza gelmeden önce uygun olmayan antibiyotiklerle tedavi edilmeye çalışılmış hastalar için kullanılır. Hasta başvurusundan önce bazı antibiyotikler kullanmışsa, klinik olarak akut pürülan menenjit tablosu ile uyumlu bulgular verdiği halde, BOS bulguları uyumsuzdur. BOSta hücre sayısı daha azdır, nötrofil oranı azalır, lenfositlerin baskın olduğu bir BOS ile karşılaşmak mümkündür (Tablo 5). BOS proteini azalır, gram boyamada veya kültürde bakteri üreme şansı da azalır. Bu durumda şeker düzeyinin düşük olması ve bakılabilirse BOSta CRP düzeyinin > 100 mg/dl olması bakteriyel menenjit tanısını destekler. Ayrıca bakteri antijenleri de yol gösterici olabilir.
Tablo 5. Akut bakteriyel menenjit kliniğine rağmen lenfositik BOS saptanması
1. Yetersiz tedavi edilmiş (iyi tedavi edil(e)memiş) bakteriyel menenjit
2. Nötropenik olgular veya total lökosit sayısının <1000/ mm3 olması
3. Listeria menenjiti
Tedavi Yaklaşımı
Bakteriyel menenjit son derece acil bir durumdur ve bu olasılık düşünüldüğü anda tedaviye başlanmalıdır. Eğer tedavi başlanmasını geciktirecekse yardımcı nörolojik incelemelerin sonuçlanması beklenmeden, hastanın görülmesinden itibaren en geç ilk 2 saat içinde ampirik tedaviye başlanmalıdır (Tablo 6, 7 ve 8). Durumun acilliği nedeni ile çoğu zaman etken ajan bilinmeden ampirik olarak tedaviye başlanır. Yine de LP yapılmışsa BOSta gram boyaması ve bakteri antijeni tayinleri yol gösterici olabilir. Bakteriyel menenjit tedavisinde kortikosteroidlerin yeri tartışmalı bir konudur. H. influenza menenjiti olan çocuklarda yapılan çalışmalarda olumlu bir etki gözlendiği için 2-3 aydan büyük çocuklarda ilk antibiyotik dozundan hemen önce deksametazon verilmesi ve 2-4 gün sürdürülmesi genel olarak kabul görmektedir. Erişkinlerde yürütülen çalışmalarda da steroid kullanımının yarar gösterme eğiliminde olduğu ortaya konmuştur. Erişkinlerde mortalite üzerine anlamlı etkisi olmasa bile işitme kaybı ve diğer nörolojik sekel oranında anlamlı azalma sağladığı gösterilmiştir. Daha az sayıda çalışmada ise steroid kullanımının herhangi faydası olmadığı rapor edilmiştir. İlk antibiyotik dozundan önce veya birlikte verilmesi ve ilk 4 gün antibiyotik tedavisi ile birlikte sürdürülmesi önerilmektedir.
Tedavi seçenekleri hastaya göre gözden geçirilmelidir. Hastanın yaşı, bağışıklık durumu, eşlik eden hastalıkları, kafa travması ve/veya cerrahi girişim öyküsü gibi özellikler tedavide seçilecek ilaçları belirleyici faktörlerdir. Bakteriyel menenjit şüphesi ve tanısı olan hastaların yatırılarak tedavi edilmesi, gereğinde yoğun bakım şartlarında izlenmesi esastır.
Tablo 6. Bağışıklık sistemi sağlam olan hastada akut bakteriyel menenjitin ampirik tedavisi#
|
Hasta |
Seçilecek tedavi* ve dozu |
|
< 3 aylık çocuk |
Ampisilin (4 x 75 mg/kg) + Seftriakson (2x 50-75 mg/kg) veya sefotaksim (4 x 50-75 mg/kg) |
|
> 3 aylık çocuk |
Sefotaksim (4 x 50-75 mg/kg) veya seftriakson (2 x 50-75 mg/kg) + vankomisin (4 x 15 mg/kg)] |
|
Erişkin |
Seftriakson (2 x 2 gr) veya sefotaksim (4 x 2 gr) [gerekirse vankomisin (2 x 1-2 gr) ve rifampisin 2x300mg eklenebilir] |
|
Yaşlı (> 60 yaş) |
Seftriakson (2 x 2 gr) veya sefotaksim (4 x 2 gr) + ampisilin (6 x 2-4 gr) |
#Burada Türkiyede önerilen tedavi yaklaşımı anlatılmaktadır (Amerika Birleşik Devletlerinde ise erişkin bir menenjit hastasında kültür ve antibiyogram sonuçları çıkana kadar seftriakson veya sefotaksime ek olarak mutlaka vankomisin ve asiklovir verilmesi önerilmektedir).
*Eğer hastada penisilin allerjisi varsa: Haemophilus influenza tip b, meningokok ve pnömokok için kloramfenikol + vankomisin; Listeria için trimetoprim-sulfametoksazol; Gram negatifler için kloramfenikol + gentamisin veya trimetoprim-sulfametoksazol + gentamisin; stafilokoklar için ise vankomisin + rifampisin kullanılabilir; yaşlılarda ise kinolonlar kullanılabilir.
Tablo 7. Bağışıklık sistemi bozukluğu varlığında akut bakteriyel menenjitin ampirik tedavisi
|
Bozukluk tipi |
Seçilecek tedavi ve dozu |
|
T-hücre / makrofaj disfonksiyonu (lökosit sayısı normal) |
Seftriakson veya sefotaksim + ampisilin |
|
T-hücre / makrofaj disfonksiyonu (lökosit sayısı azalmış) |
Seftazidim + gentamisin + vankomisin |
|
Nötropenik hasta |
Seftazidim + gentamisin |
|
Dalak işlev bozukluğu |
Seftriakson veya sefotaksim + vankomisin |
|
Travma / Nöroşirurjikal girişim sonrası |
Seftazidim + gentamisin + vankomisin |
Tablo 8. Gram boyama sonucuna göre antibiyotik tedavisi
|
Gram-pozitif koklar Gram-negatif koklar Gram-pozitif çomaklar Gram-negatif çomaklar |
Vankomisin + seftriakson Penisilin G Ampisilin / penisilin G + gentamisin Seftazidim |
Serebral Apse
Serebral apse hemen daima vücutta başka bölgedeki bir infeksiyon odağından kaynaklanır. Bunlar arasında birinci sırada paranazal sinüslerin ve kulak boşluklarının infeksiyonları gelir. Akciğer apseleri ve bronşiektazi de önemli bir grubu oluşturur. Bir diğer büyük grup da akut bakteriyel endokardit komplikasyonlarıdır. Çok daha seyrek olarak da pelvik infeksiyonlar, osteomiyelit, diş apsesi gibi fokal infeksiyonlar sorumludur. Olguların sadece % 10 kadarında travma ve intrakranial cerrahi girişimler sorumludur. Serebral apselerin üçte biri fokal yayılma ile duranın aşılması veya serebral venöz dolaşımın invazyonu ile gerçekleşir; bu durumda apse lokalizasyonu primer infeksiyona komşuluk gösterir. Uzak bir kaynaktan hematojen yolla yayılma ise olguların üçte birinde söz konusudur (metastatik apse). En sık serebral apse etkenleri arasında anaerob veya mikroaerofilik streptokoklar, bakteriodes gibi diğer anaeroblar, stafilokoklar, aktinomices, nokardia yer alır. Mantarlar da apse yapabilirler.
Patoloji
Başlangıçta lokalize inflamatuvar eksüda, damarlarda septik trombozlar ve lökosit kümeleri gözlenir. Bölge hiperemiktir ve intertisyel ödem vardır. Henüz apse sınırlarının tam kesinleşmediği bu aşamaya serebrit adı da verilir. Daha sonra ortada nekrotik bir alan meydana gelir, çevresinde de fibroblastlar prolifere olarak kapsülü meydana getirirler; böylelikle apse sınırlanmış olur. Ama tedavi edilmezse apse genişleyebilir veya çevresinde yavru apseler oluşabilir. Eğer apse kolleksiyonu dura ile araknoid membran arasındaysa subdural ampiyem, dura ile kranium kemikleri arasında ise epidural apse adını alır. Subdural ampiyemle birlikte beynin venöz sinüslerinde septik trombüs de bulunabilir.
Klinik Bulgular
Serebrit aşamasında subakut başlangıçlı başağrısı, ateş, fokal nörolojik bulgular, epileptik nöbetler görülebilir. Sonraki hafta içinde (geç serebrit dönemi) yavaş yavaş başağrısı şiddetlenir, bulantı kusma gibi kafa içi basınç artışı bulguları eklenir, ancak ateş gerileyebilir. Nöbetler görülebilir. Zamanla apsenin bulunduğu bölgeye göre değişebilen fokal nörolojik bulgular, papilla ödemi ve tedavi edilmezse uyanıklık kusuru ortaya çıkabilir ve serebral veya serebellar herniasyon gelişebilir ve hasta kaybedilebilir.
Radyolojik Bulgular
İlk 1-3 günü içeren erken serebrit döneminde BTde çevre dokudan hafifçe daha düşük dansitede (hipodens) sınırları silik bir alan ve düzensiz kontrast tutulumu görülebilir. MRda ödem ve kitle etkisi daha net anlaşılabilir. Geç serebrit döneminde (4-14 gün) yavaş yavaş çevresel kontrast tutulumu belirmeye başlar. İkinci haftadan itibaren nöroradyolojik olarak apse daha iyi görülebilir hale gelmiştir: BTde ortası hipodens, çevresi halka şeklinde kontrast tutan, onun da çevresinde yaygın ak madde ödemi bulunan bir lezyon şeklinde görülür (Şekil 1). Serebral apse tanısında MR incelemesi BTye üstündür. Ancak bu tür halka şeklinde kontrast tutan lezyonlar başka hastalıklarda da görülebilir; ayırıcı tanıda bazen tümörler, nadiren demiyelinizan hastalıklar bu şekilde karşımıza çıkabilir. Bu durumda hastada infeksiyon bulgularının/kliniğinin olması ve akut faz reaktanlarının artışı apseyi destekleyebilir. Ayrıca difüzyon MR incelemesi ve MR spektroskopi de ayrımın yapılmasında yardımcı olabilir. Eğer süpürasyon subdural veya epidural aralığa sınırlıysa, nöroradyolojik olarak kitle etkisi gösteren subdural veya epidural efüzyon şeklinde görülür.
Apse geliştikten sonra lomber ponksiyon yapılmasının serebral veya serebellar herniasyon riski taşıdığı için kontrendike olduğu unutulmamalıdır. Apse olabileceğinden klinik olarak şüphelenilen hastalarda LP öncesi mutlaka görüntüleme yapılmalıdır. Erken dönemde serebrit aşamasında LP yapılırsa, basınç biraz artmış bulunabilir; birkaç yüze kadar lökosit bulunabilir; nötrofil oranları değişkendir; protein düzeyi genellikle 100 mg/dlnin üzerindedir; şeker normal sınırlardadır. Genellikle sedimantasyon hızı artar.
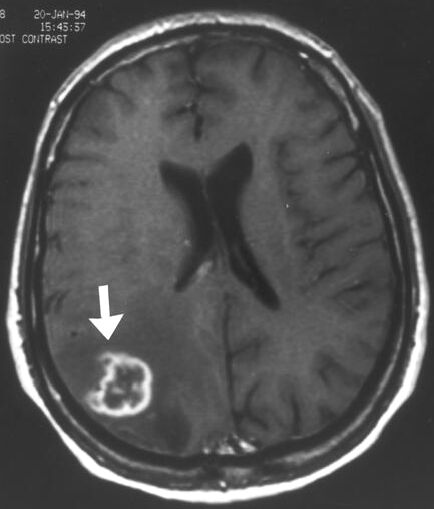
Şekil 1. Kontrastlı T1 ağırlıklı MR incelemesinde serebral apse görülmektedir.
Tedavi
Yapılabilirse özellikle çapı 2,5 cmden büyük olan apselerde veya kritik yerleşimli apselerde stereotaktik aspirasyon planlanmalıdır. Bu şekilde hem apsenin drenajı sağlanır, hem de kültür ve sitolojik inceleme yapılabilir ve tanı doğrulanarak sorumlu ajana yönelik tedavi başlanabilir. Gerektiği durumlarda drenaj tüpü de yerleştirilebilir. Bunun mümkün olmadığı durumlarda veya serebrit aşamasında ise ampirik tedavi uygulanır. Serebrit fazında yakalanmışsa, uygun antibiyotik tedavisi ile iyileşme şansı yüksektir. Akut pürülan menenjit tedavisindekine benzer dozda üçüncü kuşak sefalosporin ile birlikte metranidazol verilebilir. Eğer kafa travması veya cerrahi girişim öyküsü varsa seftazidim ile birlikte stafilokoklara yönelik olarak penisilinaza dirençli penisilin türevleri veya vankomisin verilmelidir. Eğer hastada bağışıklık sistemi ile ilgili bir bozukluk varsa mantar apseleri de akla gelmelidir. Antibiyotik tedavisi 6-8 hafta sürdürülmelidir. İki haftada bir BT veya MR ile izlenmesi uygun olacaktır. Herniasyon riski olan veya giderek kötüleşen hastalarda ödem ve kitle etkisine yönelik olarak intravenöz deksametazon veya gerekiyorsa diğer antiödem tedaviler verilebilir. Hasta nöbet geçirmişse mutlaka antiepileptik tedavi başlanmalıdır; ancak nöbeti olmayan hastada profilaksi gerekip gerekmediği tartışmalıdır. Cerrahi girişimin gerekliliği ve uygulanma şekli tartışmaya açık bir konudur. Eğer medikal tedavi altında klinik tablo kötüleşirse stereotaktik veya açık cerrahi girişimle apse aspirasyonu gerekebilir. Yetersiz drene olmuş, multiloküle, medikal tedaviye yanıtsız veya soliter, yüzeyel, iyi sınırlanmış ve yabancı cisimle ilişkili apseler cerrahi eksizyon adayıdır.
Spiroket infeksiyonları
Nörosifiliz
Etkeni Treponema pallidum olan ve cinsel yolla yayılan sifiliz hastalığının tersiyer dönemde etkilediği bölgelerden biri sinir sistemidir. Primer ve sekonder sifilizli hastalar tedavi edilmezlerse yaklaşık %7sinde nörosifiliz gelişebilir. Nörosifiliz birçok farklı klinik tablo ile kendini gösterebilirse de asıl patolojik süreç kronik ve yavaş seyirli bir leptomeningeal inflamasyondur. HIV infeksiyonu bulunan kişilerde eşzamanlı sifiliz de varsa, nörosifiliz gelişme riski daha fazladır.
Sifiliz infeksiyonunun herhangi bir döneminde hastada klinik bulgu olmaksızın BOSta sifilize bağlı bozuklukların görüldüğü asemptomatik nörosifiliz gelişebilir. Ancak nörolojik belirtisi olmayan hastalarda rutin BOS incelemesi yapılması önerilmemektedir (HIV-pozitif hastalar dışında). Semptomatik nörosifiliz ise birkaç şekilde karşımıza çıkabilir. Erken dönemde, hastalığın sekonder evresinde akut sifilitik menenjit görülür. Genellikle meningeal iritasyon bulguları ve kranial sinir tutulumları ile giden ılımlı bir akut menenjit şeklinde karşımıza çıkar. BOSta lenfosit hakimiyeti söz konusudur. Meningovasküler sifiliz ise sifilitik menenjitli hastalarda meninkslerdeki inflamasyona bağlı olarak dura içine geçen orta boy arterlerde inflamasyon (vaskülit) gelişmesi ve akımlarının bozulması sonucu ortaya çıkar. Sonuçta saatler veya günler içinde yerleşen inme tabloları görülebilir. Parenkimal nörosifiliz ise genellikle tersiyer sifiliz belirtisi olarak ortaya çıkar ve başlıca iki şekilde görülebilir. Sifilitik demans ya da diğer adıyla paralizi jeneral, hastalığın geç döneminde genellikle primer infeksiyondan 10-20 yıl sonra ortaya çıkar. Penisilinin bulunmasından sonra ender bir hastalık haline gelmiştir. Görece genç yaşta ortaya çıkan bu progresif demansiyel tablo, aylar veya birkaç yıl içinde ölümle sonlanır. Bir diğer geç komplikasyon da tabes dorsalis tablosudur. Bu da primer infeksiyondan 10-20 yıl sonra ortaya çıkar. Bulguları arasında şiddetli çakıcı ağrılar, ağır derin duyu kusuruna bağlı ataksi, yüzeyel duyu kusuru (hem hipoestezi hem hiperestezi) ve Argyl-Robertson pupil bulgusu (küçük, düzensiz, ışığa yanıtsız ama akomodasyona yanıtlı pupil) sayılabilir (Bakınız: Sinir Sistemi Semiyolojisi, Omurga ve Omurilik Hastalıkları).
Nörosifilizde BOSta ılımlı bir lenfositik pleositoz mevcuttur. Parenkimal nörosifilizde hücre sayısı normal olabilir. Protein düzeyi genellikle ılımlı olarak artmıştır. BOS şekeri normal veya hafifçe azalmış olabilir. Oligoklonal IgG bantları saptanabilir. BOSta VDRL (venereal disease research laboratory) testi çok duyarlı olmamakla birlikte özgüllüğü çok yüksek bir testtir. Buna karşın BOSta FTA-Abs (fluorescent treponema antibody-absorption) testi özgül olmayan ancak çok duyarlı bir testtir. BOS incelemesinin travmatik olduğu durumlarda yalancı pozitiflik bulunabilir. Kesin nörosifiliz tanısı için 1) klinik semptomlar olması, 2) BOSta VDRL ya da FTA-Abs testinden birinin pozitif olması ile birlikte BOSta en az bir patolojik bulgu (>20/μL pleositoz ya da >0,5 g/L yüksek protein değeri), 3) Treponemal ve nontreponemal serum testlerinin pozitif olması gerekir. Hastaların yaklaşık yarısında BOSta pleositoz saptanırken, %88de BOS protein değeri yüksek bulunmaktadır. BOS VDRL pozitifliği de yalnızca hastaların üçte birinde saptanmaktadır.
Nörosifiliz tedavisinde bugün hala penisilin kullanılmaktadır: günde 12-24 milyon ünite kristalize penisilin 10-14 gün boyunca verilir. Penisilin alerjisi olan kişilerde ise tetrasiklin, eritromisin, kloramfenikol veya seftriakson verilebilir. Tedaviden üç ay kadar sonra BOS incelemesinin tekrarlanması önerilir. Hücre sayısının normale dönmesi ve BOSta VDRL testinin negatifleşmesi beklenir. Protein daha geç normale dönebilir. Hala hücre ve VDRL pozitifliği varsa negatifleşene kadar 3 ayda bir tekrar incelenmeli ve gerekirse tekrar tedavi edilmelidir. Tedavi genellikle etkin olmakla birlikte hastaların HIV açısından ayrıntılı değerlendirilmesi önerilir.
Lyme Hastalığı
Sinir sistemini tutan bir diğer spiroket hastalığı da Lyme hastalığıdır. Etkeni olan Borrelia burgdorferi kene ısırığı (Ixodes türü- Ixodes tick-borne spirochetes) ile bulaşır. Avrupa ve Asyada görülen bir zoonozdur. Kuzey-kuzey doğu Amerikanın ve Kuzey Avrupanın ormanlık bölgeleri ile merkezi Avrupa ve Asya ülkelerinde endemik olarak bulunur. Klinik olarak kene ısırığının ardından, önce yayılan ve yer değiştiren halkasal bir döküntü ortaya çıkar (erythema migrans). Birkaç hafta ile birkaç ay içinde organ tutulumları ortaya çıkar. Bu aşamada miyaljiler, artrit, kardit ve nörolojik tutulum görülebilir. Nörolojik bulgular arasında, tek yanlı veya iki yanlı yüz felci oldukça sık ve erken rastlanan bir bulgudur. Hastaların 2/3de kranial nöropatiler görülür. Yedinci kranial sinirin yanında, ekstraoküler kasları innerve eden sinirlerin, 5 ve 8. kranial sinirlerin tutulumuna bağlı olarak çift görme, yüzde ağrı, hissizlik, başdönmesi, çınlama ve işitme kaybı gibi şikayetler ortaya çıkabilir. Bu aşamada BOSta hücre artışı olabilir veya olmayabilir. Diğer sistemik yakınmaların bulunması ve serolojik testlerle idyopatik yüz felcinden ayırdedilebilir. Bundan başka Lyme menenjiti ortaya çıkabilir. Genellikle kene ısırığından birkaç ay sonra ortaya çıkan ılımlı bir menenjit tablosu söz konusudur. Genellikle ciddi artaljiler, miyalji ve halsizlik eşlik eder. Bir diğer tablo Lyme radikülonöropatisidir (Bannwarth sendromu). Çok daha seyrek olarak da kronik ensefalopati veya akut ensefalit tablosuna yol açar. Nörolojik tutulum ile seyreden Lyme hastalığında BOSta lenfo-monositik hücre artışı görülür; hücre sayısı ilk aylarda daha yüksekken giderek azalabilir, tedaviye hızla cevap verir. BOS protein düzeyi de artmıştır; birkaç yüz mg/dlye kadar çıkabilir. Tanı, kanda ve BOSta B. burgdorferiye karşı antikorların gösterilmesi ile mümkündür. Özellikle IgM tipi antikorlar saptanırsa aktif infeksiyon lehinedir. IgG tipi antikorlar tedavi ile kaybolmazlar, bu nedenle aktif infeksiyonla geçirilmiş infeksiyonu ayırt edemezler. Ancak bu antikorların varlığı ELISA testi ile gösterildikten sonra Western Blot ile doğrulanmalıdır. Polimeraz zincir reaksiyonu (PCR) da B. burgdorferinin saptanmasında yeterince etkin bir yöntem değildir. Sonuçta Lyme hastalığı tanısı bugün başlıca klinik bulgulara dayanmaktadır. Laboratuvar yöntemlerinin geliştirilmesine gerek vardır. Nörolojik Lyme hastalığının tedavisinde seçilecek ajan sefalosporinler veya penisilindir (2 x 1-2 g /gün seftriakson veya 20 milyon ünite/gün penisilin ya da 1500-3000 mg /gün amoksisilin). Bir diğer alternatif ise 4x200 mg doksisiklindir. Tedaviyi 2-4 hafta sürdürmek gerekir. Ancak tedavi kesildikten sonra nüksler görülebilir.
Subakut ve Kronik Menenjitler
Subakut, kronik menenjitler farklı klinik tablolara sahip infeksiyöz ve infeksiyon dışı nedenlerle ortaya çıkan daha nadir bir gruptur. Subakut/kronik menenjitlerin ayırıcı tanısı Tablo 6da verilmektedir. Öncelikle infeksiyöz etyolojiye sahip olanlar ile infeksiyon dışı nedenlere bağlı menenjitlerin ayırt edilmesi önemlidir. Hastanın özgeçmişi, bilinen diğer hastalıkları, sistemik muayene bulguları ve bazı BOS özellikleri bu konuda yardımcı olabilir (Tablo 9 ve 10). Kronik infeksiyöz menenjitler arasında en sık karşılaşılan tüberküloz menenjiti ve mantarlara bağlı menenjitler aşağıda ayrıntıları ile yer almaktadır.
Tablo 9. Kronik menenjit tablosunun ayırıcı tanısı (3 nolu kaynaktan uyarlanmıştır).
|
İnfeksiyoz kökenli |
İnfeksiyon dışı nedenlere bağlı |
|
a. Tüberküloz menenjiti* b. Mantarlara bağlı menenjitler -Criptococcus neoformans* -Coccidioides immitis* -Histoplasma capsulatum -Blastomyces dermatitidis -Sporotrix schenkii -Kandida grubu -Mukormikoz c. Bruselloz d. Nöro-sifiliz e. Lyme-nöroboreliyosis f. Parazit infeksiyonları -Sistiserkoz -Toksoplazmoz g. AIDS h. Diğer viral infeksiyonlar -CMV (sitomegalovirüs) -Lenfositik koryomenenjit |
a. Meningeal karsinomatoz/lenfomatoz/lökemi b. Sarkoidoz c. Vogt Kayanagi Harada hastalığı d. Granülomatöz anjiit (primer MSS vasküliti)** d. MSS lupusu** e. Behçet hastalığı** f. Kimyasal menenjit g. IgG4 ilişkili pakimenenjit |
*meningoensefalit tablosuna da yol açabilir, ** hemen daima meningoensefalit şeklinde görülür
Tablo 10. BOS bulgularına göre kronik menenjit tablosunun ayırıcı tanısı
|
< 50 Hücre/mm3 (lenfosit baskın) |
Nötrofilik pleositoz |
Eozinofilik pleositoz |
↓ Şeker |
|
- Benign lenfositik menenjit - Karsinomatoz menenjit - Kriptokok menenjiti (HIV +) - Sarkoidoz - SLE - Vaskülitler - Behçet hastalığı* - ADEM* - NMO*
|
- Bakteriyel menenjit (actinomices, listeria, nocardia) - Kimyasal menenjit - CMV (HIV+ hastada) - Erken dönem tüberküloz menenjiti - Mantar menenjiti (aspergillus, kandida, zigomicetes) -SLE - Vaskülitler - Behçet hastalığı* - NMO* |
- Kimyasal menenjit - Coccioides menenjiti - Lenfoma -Parazitler (angiostrongylus, sistiserkoz, şistosoma) - NMO* |
- Bakteriyel menenjit (actinomices, listeria, nocardia) - Karsinom - Sistiserkoz - Tüberküloz menenjiti - Bütün mantarlar - SAK sonrası - Nöro-sifiliz - Toksoplazma - Viral menenjit - Kronik enterovirüs infeksiyonu - CMV (HIV +), geç HSV, kabakulak, LCV |
ADEM: akut disemine ensefalomiyelit; CMV: sitomegalovirüs; HIV: insan immün yetmezlik virüsü; HSV: herpes simpleks virüsü; LCV: lenfositik koryomenenjit virüsü; NMO: nöromiyelitis optika; SAK: subaraknoid kanama; SLE: sistemik lupus eritematozus
*Menenjit kliniği geri plandadır veya yoktur; parenkimal bulgular baskındır.
MSS Tüberkülozu
Tüberküloz (tbc) infeksiyonu insidansı teknolojik gelişmelere rağmen son yıllarda dünyanın her bölgesinde artış göstermektedir. Özellikle gelişmekte olan ülkelerde bu artış dikkat çekmektedir. Malnutrisyon, HIV infeksiyonu, diyabet, alkol ve madde kullanımı, kronik steroid kullanımı, böbrek yetersizliği ve hemodiyaliz, solid organ transplantasyonları ve maligniteler akciğer tüberkülozu açısından risk faktörleri arasında sayılmaktadır. Batı ülkelerinde AIDS, tüberküloz sıklığının artmasına yol açan en önemli nedenler arasında olmakla birlikte, göçmenler de önemli bir sorun oluşturmaktadır. Gelişmekte olan ülkelerde ise zaten hiç azalmamıştır. Bütün dünyada ilaca dirençli suşlar sorun yaratmaktadır. Bu nedenle tbc önemli bir sağlık sorunu olmayı halen sürdürmektedir.
Bulaşma damlacık infeksiyonu şeklinde olur. Çok az sayıda bakteri bile bulaşma için yeterlidir. Hemen daima ilk hedef akciğerlerdir. Buradan hematojen yolla diğer organlara yayılım olur. Sistemik tbc olan olguların yaklaşık %10unda sinir sistemi tutulumu gelişir. Mycobacterium tuberculosis infeksiyonunun sinir sistemi tutulumunun en sık karşılaşılan şekli tüberküloz menenjitidir. Daha seyrek olarak tüberkülomlarla parenkim tutulumu görülebilir.
Tüberküloz Menenjiti
Tüberküloz hastalığının en ağır komplikasyonudur. British Medical Research Council, 3 evrede ele alınmasını önermiştir: Evre 1de hasta uyanıktır, herhangi bir nörolojik defisiti yoktur; Evre 2de hastada konfüzyon vardır ancak uyanıklığı bozuk değildir, bazı nörolojik bulguları bulunabilir; Evre 3te ise uyanıklık kusuru veya multipl kranial sinir felçleri ya da hemipleji veya parapleji vardır.
Prodrom dönemi birkaç haftadan birkaç aya değişebilir. Bu dönemde halsizlik, miyaljiler, ateş bulunabilir. İştahsızlık ve kilo kaybı gelişir. Erişkinlerde çocuklara oranla daha kronik bir seyir görülebilir. Daha sonra başağrısı, bulantı-kusma ve apati eklenir. Bu dönemde meningeal iritasyon bulguları ortaya çıkar ve değişken düzeyde bilinç bozukluğu veya uyanıklık kusuru gelişir. Hastaların yaklaşık dörtte birinde kranial sinir felçleri (en sık 6, 7 ve 2. kranial sinirler etkilenir) gelişir, daha seyrek olarak da hemiparezi, paraparezi, nöbetler, papilla ödemi görülebilir. Durayı geçen arterlerde inflamasyona bağlı daralmalar nedeniyle inme benzeri tablolar görülebilir. Çocuklarda uyanıklık kusuru ve hidrosefali çok daha sık ve erken dönemde gelişir ve hastalık kendini daha akut bir tabloyla gösterir. Diğer pek çok fırsatçı infeksiyonun aksine, tbc infeksiyonunda altta yatan AIDS olup olmaması klinik görünümü etkilememektedir.
BOS bulguları
Tipik olarak berrak ve renksiz bir BOS ve lenfositik hücre artışı görülür (birkaç yüz civarında). Ancak ilk 24-48 saatte polimorflar baskın olabilir. Bazen AIDS hastalarında veya diğer nedenlerle bağışıklığı bozulmuş hastalarda bu polimorf hakimiyeti sürebilir. Bir de tedavi başlandıktan sonra klinikte bir kötüleşmeye eşlik eden polimorf artışı gözlenebilir ki bunun bir aşırı duyarlık reaksiyonu olduğu düşünülmektedir. Nadiren hücresel bağışıklık bozukluğu bulunan hastalarda erken günlerde BOS hücresiz olabilir. BOSta protein artmıştır, birkaç yüz miligrama kadar çıkabilir. BOS şekeri düşüktür. Tedavi ile önce şeker düzeyi yükselir (3-10 haftada), sonra hücre sayısı azalır, sonra da protein giderek normale döner.
Diğer laboratuvar tanı yöntemleri
Tüberküloz tanısı için tüberkülinin saflaştırılmış protein türevi (PPD) ile cilt testi, latent Mycobacterium tuberculosis infeksiyonlarını tespit etmek için sık kullanılan bir yöntemdir. Tüberkülin deri testinin (TST) önemli bir dezavantajı latent infeksiyonu daha önce yapılan Bacille Calmette-Guerin (BCG) ile aşılamadan ayırt edememesidir. Ayrıca tüberküloz olmayan mikobakterilere karşı da reaksiyon geliştiğinden özgüllüğü de düşüktür. Bu nedenle, tbc tanısı için kullanılan diğer bir test Qu-antiFERON® (QTF) testidir. Bu test daha spesifik olup BCG aşısından etkilenmez, hem latent hem de aktif tbc infeksiyonlarında pozitif sonuçlanır. Ayrıca diğer mikobakterilerden etkilenmez.
Tbc menenjitinde ise tanı için en kullanışlı ve bilgi verici olan BOS incelemesidir. BOSta yapılan direkt boyamada %5-25 sonuç alınır, aside dirençli kültür, Ziehl-Neelsende ise %50-60 oranında pozitif sonuç olabilir. Ayrıca kültürün 2-4 haftada sonuçlanacağı da hatırlanmalıdır. Bu testlerin negatif bulunması tanıyı dışlamaya yetmez; bu nedenle 3-4 kez BOS almak gerekebilir. Tanıda umut vaat eden bir yöntem PCR yöntemi ile BOSta M. tuberculosis DNAsının gösterilmesidir. Ancak bu yöntemin standardizasyonunun güç olması ve farklı laboratuvar ortamlarının farklı güvenilirlik koşullarına sahip olması gibi nedenlerle çok etkin bir şekilde kullanılamamaktadır. PCR, BOS kültürüne göre daha duyarlıdır, ancak PCRın negatif olması da tbc tanısını dışlatmaz. Tüberküloz menenjiti tanısında PCR yönteminin %8lere varan yalancı pozitiflik oranları bildirilmektedir. Yine de güvenilirliği kanıtlanmış bir laboratuvarda gerçekleştirildiğinde oldukça etkin bir tanı aracıdır.
Nöroradyoloji
Patolojik olarak eksüdatif bazal menenjit yapan tbc infeksiyonunda bunu BT veya MRda da görmek mümkündür. Kontrastlı incelemelerde bazal sisternaların yoğun kontrast tutulumu dikkati çeker (Şekil 2). Hidrosefali görülebilir, parenkim lezyonları varsa MRda çok daha iyi görülür. Anjiyografi yapılırsa, serebral arterlerin durayı geçtikleri noktalarda daraldıkları görülebilir. Nörogörüntülemelerde baziler meningeal kontrastlanma, hidrosefali ve supratentoriyel beyin parenkiminde infarktlardan oluşan triad görülebilir.
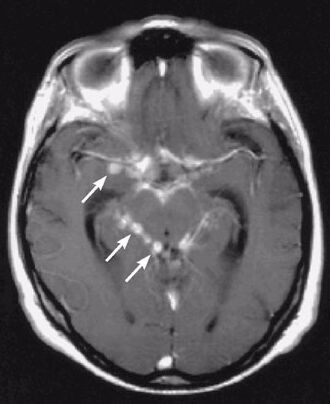
Şekil 2. Kontrastlı
MR incelemesinde bazal sisternalar düzeyinde tüberküloz menenjiti düşündüren
yoğun tutulum
Tedavi
MSS tüberkülozu tedavisinde en önemli sorun ilaçların kan beyin bariyerini geçmesidir. İzoniyazid ve pirazinamid inflamasyon olsun veya olmasın, kan beyin bariyerini kolay geçer. Buna karşın rifampisin ve streptomisin normal kan beyin bariyerini geçemez, inflamasyon varsa sınırlı miktarda geçebilir. Dirençli suş yaratmamak için birkaç ilacın birlikte kullanılması uygundur. Dünya Sağlık Örgütünün (DSÖ) önerilerine göre tedavinin ilk iki ayında izoniyazid, rifampisin ve pirazinamid ile birlikte etambutol veya streptomisinden oluşan dörtlü tedavi ile başlanır. İlk 2 aydan sonra izoniyazid ve rifampisin ile devam edilerek tedavi 10 aya tamamlanır. Bazı durumlarda eğer cevap az ve geç ortaya çıkmışsa, tedavi 12-18 ay sürdürülebilir. Eğer dirençli bir suşun varlığından şüpheleniliyorsa ilaç seçimi ona göre yapılmalı ve tedavi 24 aya kadar uzatılmalıdır. DSÖ, çoklu ilaca dirençli tbc veya yaygın olarak ilaca dirençli tbc olan tüm hastalarda hastaya özgü bir tedavi stratejisi ve ikinci basamak anti-tbc ilaçların verilmesini önerir.
Tbc menenjitinde kortikosteroidlerin kullanılması tartışmalı olmakla birlikte, kortikosteroidli veya kortikosteroidsiz antitüberküloz tedaviyi karşılaştıran yedi randomize kontrollü çalışmayı inceleyen bir meta-analizde kortikosteroidlerin en azından kısa vadede tüberküloz menenjitin mortalitesini azalttığı sonucuna varmıştır. DSÖde, tbc menenjitli hastalar için 6-8 hafta boyunca deksametazon veya prednizolon ile başlangıç adjuvan kortikosteroid tedavisini önermektedir. Ayrıca kortikosteroidlerin özellikle çocuklarda prognozu olumlu etkilediği de gösterilmiştir. Hidrosefali, herniasyon riski, spinal blok riski olan durumlarda kullanılması önerilmektedir.
Tedaviye rağmen tbc menenjitinin mortalitesi %25i bulabilir. Bu nedenle tbc menenjitinden şüphelenildiğinde ampirik tedaviye başlamakta gecikmemek gerekir. Tbc saptanan tüm hastalarda HIV ko-infeksiyonunun da gözden geçirilmesi gerekmektedir. Ayrıca iskemik inmeler, siringomiyeli gibi komplikasyonlarla kalıcı nörolojik bulgular olabileceği akılda tutulmalıdır. Uygunsuz ADH (antidiüretik hormon) sendromu ve hızlı tedavi edilen hiponatremi (yaklaşık hastaların yarısında görülür) komplikasyonu olarak santral pontin miyelinolizis açısından da dikkatli olunması gerekir.
Parenkimal MSS Tüberkülozu
Daha seyrek olarak MSS tüberkülozu karşımıza menenjit şeklinde değil de parenkim lezyonları şeklinde çıkabilir. Olguların yaklaşık %10unda menenjitle beraber bulunabilir. Tek büyük bir apse görünümünde olabileceği gibi multipl küçük lezyonlar şeklinde de görülebilir. Klinik tablo haftalar veya aylar içinde yerleşen başağrısı ve/veya epileptik nöbetlerle kendini gösterebilir. Papilla ödemi saptanabilir. BOS bulguları genellikle non-spesifiktir: tamamen normal olabileceği gibi, sadece ılımlı bir protein artışı ve/veya az sayıda lenfosit saptanabilir. Tanıya genellikle nöroradyolojik yöntemlerle varılır. BT ve MRda kortiko-medüller bileşkede veya periventriküler bölgede yerleşmiş, ya bütünüyle ya da çevresel kontrast tutulumu gösteren nodüler lezyon(lar) görülür. Eğer hedef tahtası bulgusu görülürse oldukça tipiktir. Bu durumda ortadaki kalsifikasyon BTde hiperdens görülür, etrafındaki nekroz hipodens görünür, en dıştaki kontrast tutulumu yine hiperdens görülür. MSS parenkiminde yerleşen tüberkülomların diğer nodüler lezyonlardan ayırdedilmesi için stereotaktik biyopsi gerekebilir. Tüberkülomlar erişkinlerde tipik olarak supratentoriyel yerleşim gösterirken, çocuklarda sıklıkla infratentoriyel yerleşimlidir. Nadiren omurilik parenkiminde de tüberkülom yerleşebilir; bu durumda bulunduğu seviyeye göre bulgu verir. Ancak tüberküloz seyri içinde gelişen paraparezi, akla öncelikle tüberküloz spondilitini getirmelidir (Pott apsesi, Bakınız: Omurga ve Omurilik Hastalıkları). Parenkimal MSS tüberkülozu tedavisi tüberküloz menenjiti ile aynıdır. Tedavi ile tüberkülomlar aylar (bazen yıllar) içinde küçülür ve yerinde bir kalsifikasyon odağı bırakabilir. Genellikle steroidler yarar sağlar.
a. 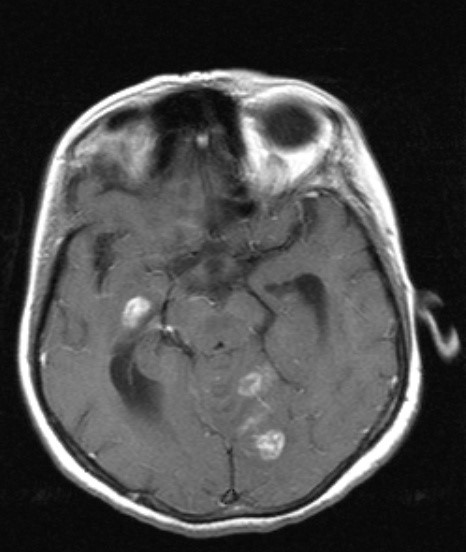 b.
b. 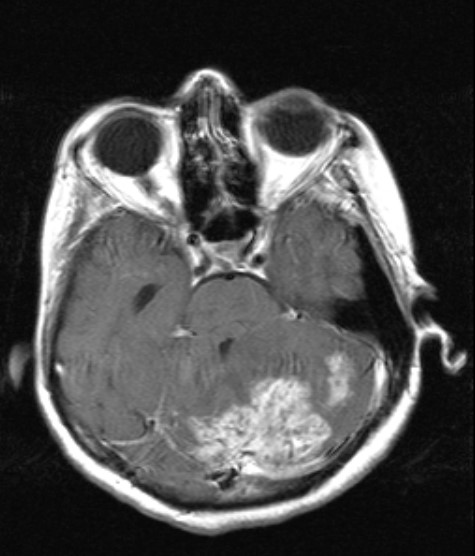 c.
c. 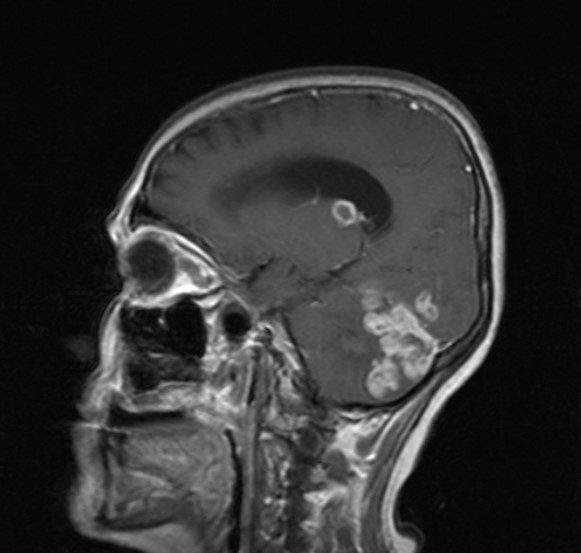
Şekil 3. Elli
bir yaşında kadın hastanın başağrısı, ateş, halsizlik, iştahsızlık, kilo
kaybı ve dengesizlik şikayetleri nedeniyle yapılan kontrastlı kranial
MR incelemesinde; kontrastlı T1 ağırlıklı aksiyel kesitlerde (a ve b), a)
sağ temporal, sol oksipital ve sol serebellar bölge yerleşimli kontrast tutan
lezyonlar ve hidrosefaliye bağlı temporal boynuzlarda genişleme, b) sol serebellar
hemisferde etrafında ödem etkisi olan ve 4. ventrikülü sıkıştırmış, kontrast
tutan lezyon, kontrastlı T1 ağırlıklı sagital kesitte c) sol serebellar hemisferde
heterojen, yoğun kontrast tutulumu gösteren yaygın ödem etkisi olan lezyonlar,
temporalde kontrast tutan lezyon ve hidrosefali görülmektedir. İncelemeler
sonucunda (beyin biyopsisi ile) bu hasta parenkimal tbc tanısı almıştır.
Mantar İnfeksiyonları
Mantarların pek çoğu sağlıklı kişilerde lokal küçük infeksiyonlar dışında infeksiyona yol açmaz. Ancak, AIDS ve terapötik immünsupresyon yöntemlerinin yaygınlaşması ile mantarlara bağlı MSS infeksiyonlarının sıklığında önemli bir artış söz konusudur. Özellikle hücresel immünitenin bozulması mantar infeksiyonlarına eğilimi arttırır. Mantar infeksiyonları vücuda ya solunum yolu ile girer, ya da kandida örneğinde olduğu gibi ağız yoluyla veya kalıcı transdermal kateterlerin infeksiyonu sonucu girer. Mantarlar farklı tipte MSS infeksiyonlarına yol açabilir. Birincisi mantar menenjitidir, bazen meningoensefalit şeklinde karşımıza çıkabilir, bir diğer tipi apse veya granülom oluşumudur, bir de damar duvarlarının tutulumuna bağlı vaskülit tabloları ve buna sekonder gelişen tıkayıcı veya kanayıcı serebrovasküler olaylar görülebilir.
Mantara bağlı menenjitlerin en sık nedeni Criptococcus neoformanstır. Genellikle subakut veya kronik bir başağrısı-ateş tablosu ile ortaya çıkar; nadiren akut menenjit gibi ortaya çıkabilir ve başka bir nörolojik bulgu olmayabilir. Olguların yaklaşık yarısında ise yavaş progresif bir demansiyel tablo söz konusu olabilir. Papilla ödemi bulunabilir. Nöroradyolojik olarak meninkslerin kontrast tutulumunun yanı sıra nodüler ve kontrast tutan kriptokokkomalar da görülebilir. Kandida grubu da yaygın infeksiyon durumlarında, özellikle intravenöz madde bağımlılarında, kronik kateter taşıyıcılarında ve immünsupresyon durumlarında menenjite yol açabilir. Başlangıç akut veya kronik olabilir. Başağrısı ve ense sertliği bulunur. Diğer menenjit etkenleri arasında Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis ve Sporotrix schenkii sayılabilir. Bunlarda da klinik tablo ve seyir kriptokok menenjitine benzer, ancak daha akut başlangıç görülebilir. Histoplazmozda organomegali eşlik edebilir.
Bazı mantarlar apse ve granülom oluşturmaya daha fazla eğilimlidirler: zigomicetes grubu, aspergillus grubu, Coccidioides immitis ve Blastomyces dermatitidis bunlar arasında sayılabilir. Bu durumda klinik tablo serebral apselerdeki gibidir. Zigomicetes grubu ve aspergillus grubu damar duvarını tutmaya da eğilimlidir.
Tanı
Mantara bağlı MSS infeksiyonlarında BOS bulguları: Genellikle açılış basıncı biraz artmıştır. Apse varsa herniasyon riski nedeniyle lomber ponksiyonun kontrendike olduğu unutulmamalıdır. BOS berrak ve renksizdir. Hücre sayısı birkaç yüze kadar (bazen 1000-2000) olabilir. Genellikle lenfositik bir hücre profili söz konusudur. Ancak, zigomicetes grubu, aspergillus grubu, Blastomyces dermatitidis ve Coccioides infeksiyonlarında nötrofil/eozinofil hakimiyeti görülebilir. BOS şekeri genellikle azalmıştır, ancak <10mg/dl ise daha çok bakteriyel bir infeksiyon akla gelmelidir. Tedaviye rağmen BOS şekerinin düşük bulunması nüksü akla getirmelidir. BOS proteini artmıştır; birkaç yüz mg/dl düzeyinde olabilir. C. neoformans BOSun çini mürekkebi ile boyanması sonucu gösterilebilir, ancak diğer mantarlar çini mürekkebi ile boyanmazlar. Ayrıca, kriptokok polisakkarit antijen tayini de kriptokok infeksiyonlarının tanı ve takibinde çok yol göstericidir. Mantar kültürleri yaklaşık %50 oranında pozitif sonuç verebilir. Bu nedenle tanıda sıklıkla serolojik testler kullanılmaktadır.
Diğer incelemeler: Nöroradyolojik incelemeler parenkimde kitle etkisi olan lezyon bulunup bulunmadığını gösterir. Ayrıca granülomlara bağlı kitle lezyonlarını da gösterir. Akciğerlerin incelenmesi primer infeksiyon odağını ortaya koyabilir. Yine kan, balgam, idrar ve gaita kültürleri mantarın ortaya konmasında yardımcı olabilir.
Tedavi
MSS mantar infeksiyonlarının tedavisi amfoterisin-B, flusitozin, flukanozol gibi sistemik antifungal ajanlarla gerçekleştirilir. Ancak tedavi uzun süre alır, nüksler görülebilir ve tedaviye rağmen mantar menenjitlerinin mortalitesi oldukça yüksektir.
Bruselloz
Bruselloz, Akdeniz, Orta Doğu, Orta Amerika ve Güney Amerika'da olduğu gibi ülkemizde de sık rastlanan bir hastalıktır. Genellikle pastörize edilmemiş süt ve süt ürünlerini tüketenlerde ya da hayvancılıkla ilgili işlerle uğraşan kişilerde rastlanır. Brusellozu olan hastaların bir bölümünde MSS tutulumu da görülebilir. Ancak tablonun sadece MSS bulguları ile ortaya çıkması olguların %5inden azında görülür. Genellikle ateş, artralji, miyalji, terleme ve halsizlik gibi sistemik bulgular eşlik eder, organomegali saptanır. MSS tutulumu subakut, kronik veya tekrarlayan menenjit şeklinde görülebilir. Sıklıkla eşlik eden kranial sinir bulguları, miyeloradikülopati tablosu veya meningoensefalit tablosu ya da nöropatiler görülebilir.
BOSta lenfositik hücre artışı saptanır. Hücre sayısı mm3te 500e varabilir. Protein düzeyi artmıştır; olguların üçte ikisinde şeker azalmıştır. Kültürde zorlukla gösterilebilir. Bruselloz tanısı daha çok serolojik yöntemlere dayanmaktadır. BOSta Brucella antikorlarının gösterilmesi tanı koydurucudur. Tedavisi doksisiklin ve rifampin kombinasyonu ile gerçekleştirilir. Genellikle tedaviyi birkaç ay sürdürmek gerekir. Hastaların klinik, BOS ve radyolojik olarak takibi önerilir.
Viral İnfeksiyonlar
Aseptik Menenjit
Herhangi bir infeksiyöz ajanın ortaya konmadığı menenjit tablolarına aseptik menenjit adı verilmiştir. İnfeksiyöz kökenli aseptik menenjit tabloları hemen hemen tamamen viral nedene bağlıdır. Aseptik menenjit ayırıcı tanısı Tablo11de verilmektedir. En sık etken enterovirüslerdir. Bunun dışında kabakulak virüsü ve herpes virüsler de aseptik menenjite yol açabilir. Viral aseptik menenjit son derece iyi seyirli bir klinik tablodur. Neredeyse her zaman sekelsiz düzelir. Özellikle enterovirüslere bağlı olanların sıklığı yaz aylarında artar. Birkaç günlük bir prodromal dönemin ardından ani yükselen ateş ve şiddetli başağrısı ortaya çıkar. Bulantı-kusma, fotofobi ve menenjizm eşlik edebilir. MSS parenkimine ait bulgu çok ender görülür. Solunum yoluna ilişkin bulgular da eşlik edebilir. Ekovirüs infeksiyonlarında bir döküntü bulunabilir, enterovirüs 71 infeksiyonunda el-ayak-ağız sendromu (herpangina) eşlik edebilir. Kabakulak virüsü söz konusu ise parotit görülebilir. Genellikle 1-2 hafta içinde tamamen iyileşme ile sonlanır. BOSta ılımlı lenfositik hücre artışı görülür. Protein düzeyi hafifçe artsa da 100 mg/dlyi geçmez. Glikoz düzeyi normaldir. Aseptik menenjit ayırıcı tanısında en önemli noktalardan biri yetersiz tedavi edilmiş ve BOS profili değişmiş pürülan menenjitin ayırt edilmesidir. Bu konu yukarıda ilgili bölümde anlatılmıştır. Lenfosit hakimiyetli BOS saptanan hastada yapılması gereken incelemeler Tablo 12de verilmektedir.
Tablo 11. Aseptik menenjit ayırıcı tanısı
|
I. Doğrudan infeksiyona bağlı |
|
|
|
|
A.Viral: |
-Enterovirüsler, arbovirüsler, herpes virüsler, kabakulak, lenfositik koryomenenjit virüsü (LCV), HIV-1 infeksiyonları -Diğer (influenza, parainfluenza, adenovirüs, kızamık, rotavirüs, parvovirüs, vs.) |
|
|
B.Bakteriyel*: |
-Yetersiz tedavi edilmiş pürülan menenjit -Spiroket infeksiyonları (sifiliz, Lyme, leptospirosis) -Bruselloz -Tüberküloz -Bartonella infeksiyonları |
|
|
C.Parazitler: |
-Primer amip meningoensefaliti -Toksoplazmoz -Sistiserkoz |
|
|
D.Mikoplazma: |
|
|
|
E. Mantarlar*: |
-Criptococcus neoformans*, Coccidioides immitis*, Histoplasma capsulatum, Blastomyces dermatitidis |
|
II. İnfeksiyona dolaylı olarak bağlı: |
-Bakteriyel endokardit -Parameningeal infeksiyonlar |
|
|
III. İnfeksiyon dışı: |
-Otoimmün hastalıklar -Kimyasal menenjit -Malignite -İlaca bağlı (nonsteroid antiinflamatuvarlar, trimetoprim-sulfametoksazol, azathioprin, IVIg, INH) |
|
*Genellikle BOS protein ve şeker düzeyleri ile viral menenjitten kolayca ayırdedilebilir.
Tablo 12. Lenfositik menenjitte yapılması gereken incelemeler
|
Akut seyir |
Kronik seyir |
|
BOS: -Hücre sayımı, şeker, protein -Gram boyama, bakteri kültürleri -Kriptokok antijeni -Aside dirençli basil için yayma -Lateks aglutinasyon testleri (HIB, pnömokok ve meningokok) -VDRL -HSV için PCR (immun-yetersizlik varsa VZV de) -Virüs-spesifik IgM antikorlar Kan: -Tam kan sayımı, yayma -HIV -Lyme (ELISA) -VDRL-TPHA -Seroloji titre takibi: enterovirüsler, HSV II, adenovirüs, LCV, EBV |
BOS: (rutin testlere ek olarak) -Sitoloji -ACE* -Kriptokok antijeni -Lyme, brusella, histoplasma ve coccidioides antikorları -PCR: tüberküloz, HSV, VZV Kan: -Yanda sayılanların hepsi -Kültürler -Sedimantasyon hızı, ANA, RF -Sjögren antijenleri -ACE -Protein elektroforezi -Lyme ve brusella serolojisi Diğer: -MRG -Akciğer grafisi -PPD testi |
HIB: Haemophilus influenza tip b; CMV: sitomegalovirüs; EBV: Epstein Barr virüsü; HSV: herpes simpleks virüsü; HIV: insan immün yetmezlik virüsü; SAK: subaraknoid kanama; SLE: sistemik lupus eritematozus; LCV: lenfositik koryomenenjit; PCR: polimeraz zincir reaksiyonu; ACE: anjiotensin converting enzim VZV: Varicella zoster virüsü); ELISA: (enzyme linked immunoabsorbent assay); TPHA: Treponema hemaglütinasyon absorbsiyon testi, VDRL: (venereal disease research laboratory test): ANA: antinükleer antijen; RF: romatoid faktör; PPD:tüberkülin deri testi.
*klinik değeri tam ortaya konmuş değildir.
Viral Ensefalitler / Miyelitler
Ensefalit, ateş, başağrısı, davranış ve uyanıklık bozukluğu ile giden MSS parenkiminin akut inflamasyonu olarak tanımlanabilir. Genellikle eşlik eden başka nörolojik bulgular ve nöbetler de bulunabilir. Omuriliğin ön planda tutulduğu durumlarda ise miyelitten söz edilir. Doğrudan viral ajan tarafından oluşturulabileceği gibi, sistemik bir infeksiyona çapraz reaksiyon olarak da gelişebilir. Bu ikinci duruma para-infeksiyöz veya post-infeksiyöz ensefalomiyelit adı verilir; bu tablo kitabın başka bir bölümünde anlatılmaktadır (Bakınız: Merkezi Sinir Sisteminin Miyelin Hastalıkları).
Viral ensefalitlerden özellikle herpes ensefaliti ağır nörolojik sekeller bırakabileceğinden ve tedavi edilebilir bir durum olduğundan dolayı acil nöroloji pratiğinde önemli bir yer tutar. Tanıya çoğu zaman klinik kuşku sonucu, EEG ve MRG gibi incelemelerin desteği ve diğer olasılıkların dışlanması ile varılır. Çoğu zaman tedaviye ampirik olarak başlanır. Tedavi her zaman yüz güldürücü olmayabilir.
Herpesvirüs İnfeksiyonları
Herpesvirüsler MSS parenkimini tutmaya eğilimli virüslerin başında gelirler. Bugüne dek tanımlanmış çoğu alt tipinin nörotrop olduğu düşünülmektedir. Bunlardan Herpes Simpleks Virüs (HSV) tip I, klasik herpes ensefalitinden sorumludur. Genital herpes infeksiyonu etkeni olan HSV tip II ise neonatal ensefalitten sorumludur; erişkinlerde daha çok aseptik menenjite yol açar. Nadiren miyelit veya ensefalit ile ilişkili olabilir. Varicella Zoster virüsü (VZV) ise çocukluk infeksiyonlarından suçiçeğinin etkenidir. Erişkinlerde ise latent hale geçtiği arka kök ganglionunda yıllar sonra aktive olarak zona infeksiyonuna yol açar. Daha seyrek olarak da miyelit veya ensefalite yol açabilir. Ensefalit için özellikle kranial veya servikal dermatomal tutulum önemli bir risk faktörüdür. HSV tip IV veya Epstein Barr virüsü (EBV) nadiren MSS parenkimini tutar. Bu durumda serebellar ataksi görülebilir; daha seyrek olarak da ağır ensefalit tablosu izlenir. HSV tip V veya Sitomegalovirüs (CMV) ise bağışıklık sistemi sağlam olan kişilerde MSS infeksiyonuna yol açmaz; akut inflamatuvar demiyelinizan polinöropati (AIDP) ile ilişkisi bilinmektedir. Bağışıklık sisteminde bozukluk olan kişilerde ise subakut ensefalit, progresif miyelit ve poliradikülite yol açabilir. Görece yeni tanımlanan HHV tip VInın da özellikle bağışıklık sistemi baskılanmış bireylerde nadir de olsa ensefalit ve miyelit tablosuna neden olabileceği bilinmektedir.
Herpes Ensefaliti: HSV tip I ensefaliti en sık görülen sporadik ensefalittir ve dünyanın her bölgesinde, her yaşta ve her mevsimde görülebilir. Tüm viral ensefalitlerin yaklaşık %20inden sorumlu olan HSV tip I ile primer infeksiyon orofaringeal mukozada yerleşir. Asemptomatik olabileceği gibi, mukozada ağrılı herpetik lezyonlar ve ateş tablosu da görülebilir. Birkaç haftada semptomlar kaybolur, ancak virüs retrograd transnöronal taşınma ile trigeminal gangliona gelir ve burada latent olarak kalır. Zaman zaman, özellikle immünsupresyon durumlarında reaktive olabilir. Bazen de bu reaktivasyon ensefalit tablosu şeklinde olabilir. Ancak herpes ensefaliti bağışıklık sistemi normal kişilerde de görüldüğünden, altında immünsupresyona yol açan bir neden aramak gerekmez.
HSV tip I ensefalitinde ateş, başağrısı, konfüzyon ve davranış değişiklikleri görülür. Bulgular günler veya haftalar içinde ilerler. Nöbetler, afazi gibi fokal nörolojik bulgular görülebilir. Tanı nöroradyoloji, EEG ve BOS bulgularına dayanır. HSV tip I ensefaliti beyinde başlıca temporal korteks ve limbik sistem yapıları gibi belirli bölgeleri tutma eğilimindedir. BTde kolay görünmese de MRG ile bu bölgelerin tek yanlı veya iki yanlı tipik tutulumu bu tanıyı hemen akla getirmelidir (Şekil 4). Ancak diğer nedenlere bağlı limbik ensefalitlerde de benzer lezyonlar görülebileceği unutulmamalıdır. Bazen hemorajik bir kitle şeklinde veya beyinsapı ensefaliti şeklinde de görülebilir. Difüzyon ağırlıklı MR incelemelerinde (DWI-ADC) difüzyon kısıtlılığı şeklinde kendini gösterebilir. Ancak çok erken dönemde (ilk 1-2 günde) MRG normal olabilir. EEGde de temporal bölgelerin tutulduğuna işaret eden periyodik deşarjlar (lateralizan epileptiform/nonepileptiform özellikte, eski adıyla PLED) spesifik olmasa da HSV ensefalitini akla getiren bir bulgudur (Bakınız: Elektroensefalografi). Genellikle ilk 15 gün içinde bu deşarjlar görülür, daha sonra kaybolabilir. Bunun haricinde de hastaların yaklaşık %80inde fokal EEG anormallikleri görülür.
Şekil 4. Herpes simpleks ensefaliti tanısı ile izlenen bir hastada BT (A) ve MR incelemelerinde (B-F) tipik temporal lob tutulumu (B,C: T1 ağırlıklı kontrastlı; D,E: T2 ağırlıklı;. F: Proton yoğunluğu sekanslarında MR kesitleri)
BOS açılış basıncı yükselmiş olarak bulunabilir; berrak-renksiz veya ksantokromik olabilir. Milimetreküpte birkaç yüze varan (nadiren 2000e kadar) lenfositik pleositoz ve ılımlı bir protein artışı görülür; glikoz sıklıkla normaldir. BOSta eritrosit hastaların yaklaşık %85inde bulunabilir. Spesifik tanıda altın standart PCR yöntemi ile HSV DNAsının aranmasıdır. Bu testin duyarlılığı %98, özgüllüğü ise %95-100 aralığındadır. BOSta saptanan HSV antikorları da tanıda yardımcı olabilir. Eşzamanlı alınan serumda saptanan antikor düzeyine göre BOS düzeyinin 20 kat veya daha fazla olması beklenir. Ancak BOSta antikorların ancak ilk 10 günden sonra saptanabilmesi nedeniyle bu test ancak tanının retrospektif olarak doğrulanması amacıyla kullanılmaktadır. Kişiler genellikle çocukluktan beri HSV ile karşılaşmış olduklarından, serum HSV antikorları genellikle tanıda yardımcı olmazlar; eğer IgM pozitifliği saptanırsa anlamlıdır. Önceki yıllarda HSV tanısı için şart koşulan beyin biyopsisi ise artık nadiren gerekmektedir.
HSV tip I ensefaliti morbidite ve mortalitesi çok yüksek bir hastalık olduğundan, klinik olarak akla geldiğinde tanının doğrulanması beklenmeden tedaviye başlanmalıdır. HSV tip I ensefalitinin tedavisi her 8 saatte bir intravenöz 10mg/kg asiklovir ile yapılır. Hastada ciddi bir immün yetersizlik de varsa ayırıcı tanıda bulunan CMV ve HHV IV ensefaliti için ampirik tedaviye gansiklovir de eklenmelidir. Tedavi 2-3 hafta sürdürülmelidir. Asiklovir, böbrek yetersizliği olanlar dışında oldukça güvenli bir ilaçtır. Asiklovire dirençli suşlar için yeni antiviral ajanlar kullanılmaktadır. Oldukça ciddi bir hastalık olan herpes ensefalitinde, tedaviye rağmen mortalite %20-30 kadar yüksektir. İyileşen hastaların da yaklaşık %60ında sekel kalmaktadır. Ayrıca HSV tip I ensefalitinin, N-metil D-aspartat (NMDA) reseptör antikorları ile ilişkili otoimmün ensefalit ile bağlantısı ve tekrarlayan limbik ensefalit tablolarına yol açabileceği gösterilmiştir. Bu durumda uzun süreli immunoterapi yapmak gerekebilir.
Zona ve VZVnin Diğer MSS İnfeksiyonları (Ayrıca bakınız: Spinal Sinir Kökleri ve Hastalıkları, Kranial Nöropatiler): VZV çocukluk infeksiyonlarından suçiçeğinin etkenidir. Daha sonra arka kök ganglionunda latent hale geçer ve yıllarca sessiz kalır. Erişkinlerde ya ileri yaşla birlikte ya da immünsupresyon durumlarında reaktive olarak zona infeksiyonuna yol açar. Zona genellikle tek yanlı 1-3 dermatom alanında ağrılı ve eritemli bir zemin üzerinde veziküler döküntü ile karakterizedir (Şekil 5). En sık torakal dermatomlarda görülür. Ancak kranial sinirler de dahil bütün dermatomlarda görülebilir. Sık etkilenen sinirlerden biri olan trigeminal sinirin en fazla oftalmik dalı tutulur; bu durumda gözü koruyucu önlemler almak önemlidir. Fasiyal sinir tutulduğunda dış kulak yolunda döküntüyü gözden kaçırmamak gerekmektedir (Ramsay-Hunt sendromu). Bu tabloya kulak ağrısı da eşlik edebilir. Zona infeksiyonunun en rahatsız edici yanı etkilenen dermatomda şiddetli batıcı ve yanıcı ağrı olmasıdır. Kimi zaman döküntü olmadan da bu ağrılı tablo gelişebilir. Bu durumu zoster sine herpete adı verilmiştir. Ağrı 4-6 hafta kadar sürebilir. Hastaların yaklaşık %10-15inde döküntü iyileştikten sonra da uzun süre devam edebilir; bu durumda post-herpetik nevraljiden söz edilir. Nadiren döküntülü dönemde etkilenen dermatomun katıldığı omurilik segmentinde inflamasyona (miyelit) yol açabildiği bildirilmiştir.
Miyelit ve post-herpetik nevralji dışında zona infeksiyonunun başka komplikasyonları da olabilir. Bunlardan biri VZV ile ilişkili granülomatöz arterit gelişimidir ve ilgili arter alanlarında inmelerle kendini gösterir. Özellikle bağışıklık sistemi baskılanmış hastalarda ensefalit tablosu görülebilir. Kranial veya servikal dermatomların tutulması ensefalit gelişiminde bir risk faktörüdür. Her iki durumda da BOSta ılımlı bir lenfositik hücre artışı görülür, tanıda PCR çok yardımcıdır. Ayrıca VZV aseptik menenjit etkenlerinden biridir. Diğer herpesvirüslerde olduğu gibi VZV'de de yalancı pozitiflik hemen hemen hiç görülmez. Zona tedavisinde asiklovirin yeri tartışmalı bir konudur. Ancak, döküntü süresini kısalttığı ve post-herpetik nevralji olasılığını azalttığı düşünülmektedir. Ayrıca bağışıklık sisteminde bozukluk olan hastalarda komplikasyonları önlemek için kullanılabilir. VZV ensefalitinde kullanılması gereken doz HSV ensefalitindeki gibidir. Zona ağrısı için kodein dahil çeşitli analjezikler kullanılabilir. Bağışıklık sistemi sağlam olan hastada steroidler de yararlı olabilir.
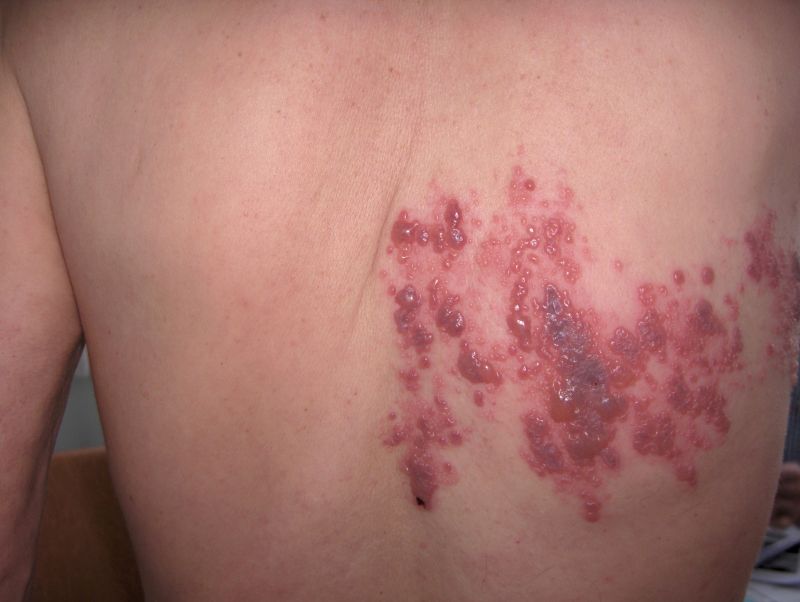
Şekil 5. Zona döküntüsü (Prof. Dr. Can Baykalın arşivinden)
Enterovirüsler
Aralarında Coxsackie A ve B (özellikle A9, B2 ve B5), ekovirüsler, poliovirüs ve enterovirüs 70 ve 71in sayılabileceği enterovirüsler aseptik menenjitin en sık nedenidir. Bazen bir meningoensefalite de yol açabilirler. Enterovirüs ensefaliti genellikle bir makülo-papüler döküntü ve nöbetlerle karakterizedir. Çocuklarda ve genç erişkinlerde daha sıklıkla izlenir. Ayrıca MSS parenkimine ait çeşitli bulgular, örneğin davranış değişikliği, beyinsapı bulguları, miyelopati bulguları ve özellikle enterovirüs D68 ve A71 tiplerinde polio benzeri paralitik tablolar görülebilir ve mevsimsel salgınlar şeklinde ortaya çıkabilir. Döküntü nedeniyle meningokok menenjiti ile karıştırılabilir. Ancak peteşi görülmez. Ayrıca, BOSta lenfositik hücre artışı ve ılımlı protein artışı görülür. Kesin tanı virüs kültürü veya RT (ters transkriptaz)-PCR ile konur; ayrıca serum ve BOSta antikorlar da gösterilebilir. Hasta tamamen düzelebileceği gibi, ağır sekelle iyileşebilir veya ölümle sonlanabilir.
Enterovirüs infeksiyonları arasında poliovirüs infeksiyonlarını ayrı ele almak gerekir. Aşılama kampanyalarına rağmen poliomiyelit ülkemizde hala önemli bir sağlık sorunu olmayı sürdürmektedir. Çeşitli klinik formlarda karşımıza çıkabilir. Non-paralitik form daha çok aseptik menenjit kliniği gösterir. Bu durum kendiliğinden düzelebileceği gibi, bazen polio ensefalitine dönüşebilir, bazen de paralitik polio tablosuna dönüşür. Paralitik poliomiyelitte en sık lomber bölge tutulur. Proksimal kaslarda daha belirgin olan ve sıklıkla belli kas gruplarının tutulduğu gevşek ve asimetrik bir paraliziye neden olur. İlk 5-6 gün paralizi alanı yayılabilir. Yaklaşık olarak olguların %10unda bulber bölge de tutulabilir. Tutulan ekstremitede ağır atrofik sekel kalır. Akut infeksiyon döneminde BOS bulguları aseptik menenjite benzer. Tanıda, klinik bulgular en önemli yol gösterici olsa da, altın standart gaitada virüsün gösterilmesidir.. Yaygın aşılama ile önlenmesi dışında bilinen bir tedavisi yoktur. Poliomiyelit infeksiyonundan yıllar sonra ortaya çıkabilen ve progresif zaafla seyreden bir komplikasyonu ise post-polio sendromudur (Bakınız: Omurga ve Omurilik Hastalıkları).
Arbovirüsler
Artropodlarla taşınan virüslere bağlı ensefalit ülkemizde endemik olarak bulunmasa da son dönemde özellikle Batı Nil virüsü ile ilişkili nörolojik tablolar daha sık bildirilmeye başlanmıştır. Bu grupta Batı Nil virüsü dışında Kaliforniya grubu virüsler (La Crosse virüsü), St Louis ensefalit virüsü, Japon B ensefaliti virüsü, doğu ve batı equine (at) ensefaliti virüsü ve Venezuella equine ensefaliti virüsü de bulunur. Genellikle yaz sonu ve sonbahar başında salgınlar halinde görülür. Bunlar içinde en ağır seyreden ve mortalitesi en yüksek olan doğu equine ensefalitidir. Diğerleri genellikle konfüzyona yol açan ılımlı bir ateşli hastalık şeklinde geçer. Batı Nil virüsü ensefalit, menenjit ve polio benzeri flask paraliziye neden olabilir. Menenjit tablosu tipik bir viral menenjit gibidir. Ensefaliti ise hafif seyirli tablolardan koma ve ölüme yol açabilen ağır klinik tablolara kadar farklı şiddetlerde kendini gösterebilir. Batı Nil ensefalitinde ekstrapiramidal bulguların izlenmesi tanıda yol göstericidir. Bunun dışında brakiyal pleksopati, demiyelinizan ve aksonal polinöropati gibi renkli klinik tablolara da neden olduğu gösterilmiştir. MR görüntüleri tipik değildir; leptomeningeal veya periventriküler kontrast tutulumu veya bazal ganglionlarda hiperintensite görülebilir. Arbovirüs infeksiyonlarında BOSta erken dönemde nötrofilik, daha sonra lenfositik bir pleositoz görülür. Tanıda serum antikor titrelerinde 4 kata varan artış, BOSta IgM tipi antikorların bulunması veya virüs izolasyonu gerekir. Artropodlarla taşınan virüslere bağlı ensefalitlerin destek tedavisi dışında tedavisi yoktur.
Kuduz
Ülkemizde kuduz halen önemli bir sağlık sorunu olmayı sürdürmektedir. Genellikle infekte bir hayvan tarafından ısırılma sonucunda bulaşır. Periferik sinirler boyunca MSSye taşınır ve orada trans-sinaptik yayılır. Kuduz bir hayvan tarafından ısırılan bütün insanlarda hastalık ortaya çıkmayabilir, ancak belirtiler ortaya çıktıktan sonra tablo ölümle sonlanır. Isırılan bölgenin beyne uzaklığına göre değişmekle beraber, 20-60 günlük bir kuluçka döneminden sonra prodromal dönemde ateş, başağrısı ve halsizlik ortaya çıkar. Giderek iritabilite, davranış değişiklikleri, hiperaktivite ve saldırganlık, nöbetler, yutma güçlüğüne bağlı hidrofobi gelişir; birkaç hafta içinde koma ve ölümle sonlanır. Asemptomatik dönemde tanı koyma şansı hemen hemen hiç yoktur. Semptomlar ortaya çıktığında ense cildinden tam kat biyopsi alınarak RT-PCR yöntemi uygulanabilir veya smearlerinde kuduz antijeni gösterilebilir (duyarlılık: %50-90; özgüllük: %100). Vücut sıvılarından yapılan RT-PCR testlerin duyarlılığı düşüktür ve kimi zaman birden fazla test yapmak gerekebilir. Kesin tanı beyin dokusunda Negri cisimlerinin görülmesi ile konur.
Semptomlar ortaya çıktıktan sonra destek tedavisi dışında yapılabilecek hiçbir şey yoktur. Bu nedenle, profilaktik tedavinin önemi büyüktür. Eğer bir ev hayvanı tarafından ısırılma söz konusu ise 10 günlük gözlem süresi yeterlidir. Bu 10 gün içinde hayvanda kudurma belirtileri ortaya çıkarsa profilaksi uygulanmaya başlanır. Eğer ısırma hayvanın doğasına aykırı bir biçimde meydana gelmişse (provoke edilmeden, vs.), kuduz riski olan bir bölgede olmuşsa veya hayvan kaçmışsa profilaksiye başlanır. Yapılması gereken 3 basamak vardır:
1) Yara bölgesinin bol su-sabun veya benzalkonium klorür ile yıkanması; (Yara yerinin bol su ve sabunla yıkanması başlı başına kuduz riskini %90a kadar azaltmaktadır.)
2) 20 IU/kg kuduz immünglobulini verilmesi (mümkün olan en yüksek dozun yara içine uygulanması kalan kısmın ise intramüsküler olarak yapılması şeklinde) (Eğer kişi daha önceden kuduz aşısı olmuşsa bu basamak uygulanmamalıdır);
3) İnsan diploid hücre aşısı uygulaması. Buna ısırılma sonrası mümkün olan en kısa zamanda başlanır ve 3., 7. ve 14. günlerde tekrarlanır. Hasta immünsuprese ise 28. günde bir doz daha uygulanır. Daha önceden kullanılmakta olan diğer aşılarla sık görülen akut disemine ensefalomiyelit ve akut inflamatuvar poliradikülopati gibi komplikasyonlar, bu aşı ile görülmemektedir.
Kronik Persistan Viral İnfeksiyonlar (Yavaş-Virüs İnfeksiyonları)
Bazı viral infeksiyonlar sinir sistemine yerleştikten sonra çok uzun bir latent dönemin ardından hastalık belirtilerine yol açarlar. Önceleri dejeneratif hastalıklar arasında sayılan pek çok hastalığın aslında böyle bir kronik viral infeksiyon hastalığı olduğu anlaşılmıştır. Bu hastalıklar arasında kızamık virüsünün neden olduğu subakut sklerozan panensefalit, bağışıklık sisteminde bozukluk olan hastalarda yine kızamık virüsüne bağlı subakut kızamık ensefaliti, progresif kızamıkçık panensefaliti, bir retrovirüs olan HTLV-1 virüsüne bağlı tropikal spastik paraparezi, bir papovavirüs olan JC virüsüne bağlı progresif multifokal lökoensefalopati, AIDS-demans kompleksi ve prion hastalıkları sayılabilir. Ayrıca gerek HSV 1 ve 2, gerekse VZVnin arka kök ganglionunda uzun yıllar sessiz kaldıktan sonra reaktive olarak ensefalite ve zona tablosuna yol açtığı bilinmektedir. Aynı şekilde CMV ve EBV de uzun zaman latent olarak kalabilir. Geçmişten gelen bu bilgiler ışığında etyolojisi henüz bilinmeyen multipl skleroz, motor nöron hastalığı gibi diğer nörolojik hastalıkların da bir kronik viral infeksiyonla olası ilişkisi halen araştırılmaktadır.
Subakut Sklerozan Panensefalit (SSPE)
Kızamık infeksiyonundan yıllar sonra ortaya çıkan nadir, ancak ağır nörolojik yıkıma ve ölüme giden progresif seyirli bir hastalıktır. İlk kez 1933te Dawson tarafından inklüzyon cisimli dejeneratif bir süreç olarak tanımlanmış; kızamıkla ilişkisi ise 1960larda anlaşılmıştır. Kızamık infeksiyonu sonrası 6 yıl içinde gelişme şansı bir milyonda 8,5 olarak hesaplanmıştır. Kızamık aşısının bulunmasından sonra bu risk yıllar içerisinde bir milyonda 0,06ya kadar düşmüştür. Genellikle kızamık infeksiyonunun 2 yaşından önce geçirilmesinin SSPE gelişmesine eğilim yarattığı düşünülmektedir; erkeklerde biraz daha sık görülür. Hastalık infeksiyonun geçirilmesinden yaklaşık 8-10 yıl sonra ortaya çıkar.
Klinik olarak 4 evresi vardır. Evre 1de yavaş gelişen davranış değişikliği ve okul başarısında düşme görülür ve bu evre aylar sürebilir. Evre IIde dakikada 5-10 defa görülen yavaş miyoklonik sıçramalar ortaya çıkar; bunlarla eş zamanlı olarak EEGde periyodik tekrarlayan yüksek amplitüdlü stereotipik yavaş dalga aktivitesi tipiktir (Bakınız: Elektroensefalografi). Bu evre birkaç ay sürer ve zamanla nöbetler, koordinasyon bozukluğu, ilerleyen demansiyel tablo ve diğer istemsiz hareketler ortaya çıkar. Bu evre genellikle aylar sürer. Evre IIIte ise demansiyel bir tablo ile birlikte kimi zaman flask paralizi, kimi zaman ise genel tonus artışı gelişir ve giderek deserebrasyon rijiditesine ilerler. Evre IVte deserebre rijidite belirginleşir, psödo-bulber paralizi ortaya çıkar, giderek mutizm koma ve ölümle sonlanır. Evre III ve IVte miyokloni genellikle kaybolur. Bu gidiş genellikle 1-2 yıl içinde tamamlanırsa da, bazı olgularda Evre III ve IV arasında kısmi bir düzelme ve yıllarca stabil seyretme söz konusu olabilir. Kimi zaman ataklı bir seyir izlenebilir.
SSPE tanısında klinik ve EEG bulgularının yanı sıra serolojik bulgular kullanılır. BOS genellikle hücresizdir, protein düzeyi artmış olabilir. Özellikle immünglobulin düzeyi artmıştır ve oligoklonal bantlar ile gösterilen intratekal IgG sentezi söz konusudur. BOSta saptanan oligoklonal bantların çoğu kızamığa karşı antikorlar içerir. BOSta serolojik olarak da kızamık antikorları saptanır; bunların serumdaki antikorlara oranının artmış olması SSPE tanısını destekler. Kranyal MRGde hastalığın evrelerine göre değişen bulgular saptanır. Bugün SSPEnin kesin bir tedavisi yoktur. Ancak inosipleks tedavisinin sağ kalımı uzatabildiği bildirilmiştir, interferonlar ve ribavirin de denenmektedir.
Prion hastalıkları (Bulaşıcı Spongiform Ensefalopatiler)
(Ayrıca bakınız: Demans Sendromu, Alzheimer Hastalığı ve Alzheimer Dışı Demanslar)
Önceleri nadir hastalıklar arasında sayılan spongiform ensefalopatiler, 1990lardaki deli dana hastalığı (bovine spongiform encephalopathy) salgını ve bu hastalığın sığırlardan insanlara bulaşabileceği düşünülünce kamuoyunu ilgilendirmeye başlamıştır. İnsanlarda görülebilen spongiform ensefalopatileri sporadik, edinsel ve genetik olarak üç grupta ele almak mümkündür. Sporadik form %85 oranında, genetik form %15 oranında görülür; edinsel form ise %1den azdır. Genetik grupta ailevi Creutzfeldt-Jacob hastalığı, Gerstmann-Sträussler-Scheinker hastalığı ve fatal familyal insomni hastalığı yer alır. Bunların hepsi otozomal dominant geçişlidir ve tümünde 20.kromozomda PrP proteinini kodlayan PRNP geninde mutasyon saptanmıştır. Günümüze dek bu gende 50den fazla mutasyon bildirilmiştir. Edinsel spongiform ensefalopatiler arasında ise iyatrojenik Creutzfeldt-Jacob hastalığı, yamyamlık geleneğinin sürdüğü toplumlarda rastlanan Kuru hastalığı ve deli dana hastalığı ile ilişkili olabileceği düşünülen yeni varyant Creutzfeldt-Jacob hastalığı sayılabilir. Bulaşıcı olan bu hastalıklarda infeksiyon ajanı diğer bilinen ajanlardan farklıdır ve prion olarak adlandırılmıştır. Bu prionun yapısı araştırılırken PrP proteini ve hasta bireylerde görülen proteaza dirençli varyantı PrPsc ortaya konmuştur. PrPscnin normal MSS dokusuna girdiğinde burada bulunan normal PrPnin PrPscye dönüşmesine neden olduğu gösterilmiştir.
Creutzfeldt-Jacob Hastalığı: Seyrek rastlanan ancak progresif nörolojik yıkım sonucu öldürücü olan bir hastalıktır. Bir milyonda bir kişide görüldüğü düşünülmektedir. Genellikle 7. dekadda ortaya çıkar. Nörolojik bulguların ortaya çıkmasından önce bir prodrom dönemi olabilir. Bu dönemde halsizlik, iştahsızlık, uyku sorunları, kilo kaybı ve kaygı-depresyon gibi psikiyatrik belirtiler görülebilir. Ardından davranış değişikliği ortaya çıkar. Buna ataksi, piramidal/ekstrapiramidal bulgular gibi başka nörolojik bulgular da eşlik edebilir, ancak tipik olarak spontan veya ani sesle ortaya çıkan irkilmeler (miyoklonik sıçramalar) görülür; bu dönemde tipik periyodik EEG paroksizmleri saptanabilir (Bakınız: Elektroensefalografi). BOS hücresizdir, hafif protein artışı görülebilir (<100 mg/dl); BOSta 14-3-3 proteini, tau proteini gibi bazı proteinlerin düzeyi armış saptanır ama özellikle total tau proteininin fosfo-tau proteinine olan oranının yükselmesi Creutzfeldt-Jacob hastalığını düşündürmelidir. Ayrıca son yıllarda real-time quaking-induced conversion (RT-QuIC) tekniği ile PrPsc gösterilebilir hale gelmiştir. Kranial MR, klasik T1 ve T2 ağırlıklı incelemelerde genellikle atrofi dışında bir bulgu vermez, ancak FLAIR ve difüzyon ağırlıklı incelemelerde prion hastalıkları için çok tipik bir bulgu olan kortikal kurdele görüntüsü tanı koydurucu olabilir (Şekil 6). Korteks dışında bazal gangliada da hiperintensite izlenebilir. Ayrıca MR diğer tanı olasılıklarının dışlanması açısından da yararlıdır. Hastalığın ortalama süresi aylarla sınırlıdır. Haftalar ve aylar içinde hızla progresif bir demans ve akinetik mutizm tablosu gelişir ve 6 ay içinde ölümle sonlanır. Kesin tanı için histopatolojik inceleme şarttır. Creutzfeldt-Jacob hastalığının bilinen bir tedavisi yoktur. Hastalık MSS dokusu veya kornea ile direkt temas sonucu bulaşır. Kadavra dokusundan hazırlanan hormonların kullanımı ile ilişkisi de belirlenmiştir. Kan ve kan ürünlerinin bulaştırma riski düşüktür. İnfeksiyöz ajan kaynatmaya, formalin ve alkole dirençlidir; ancak, 1320 Cda 1 saat otoklava veya %5 sodyum hipokloritte (çamaşır suyu) 1 saat beklemeye duyarlıdır.
Deli dana hastalığı taşıyan sığır etinin yenmesi sonucu ortaya çıktığı düşünülen yeni varyant Creutzfeldt-Jacob hastalığının bazı klinik özellikleri sporadik Creutzfeldt-Jacob hastalığına göre belirgin farklılıklar gösterir. Hastalık çok daha genç yaşta başlar; ortalama başlangıç yaşı 26dır. Hastalık süresi daha uzundur ve başlangıçta uzun bir dönem psikiyatrik belirtilerle sınırlıdır. Sporadik formda görülmeyen duysal belirtiler sıktır. Yine sporadik form için tipik olan EEG paroksizmleri görülmez. MRda ise talamusun pulvinar çekirdeğinde hiperintensite görülür. Yine sporadik formun aksine, varyant Creutzfeldt-Jacob hastalarının tonsil, dalak ve lenf nodu gibi lenfoid organlarında PrPsc saptanabilir ve tanıda tonsil biyopsisi kullanılabilir. Dünya Sağlık Örgütünün 2001 yılında yayınladığı düzeltilmiş kriterlere göre varyant Creutzfeld-Jacob hastalığı kesin tanısı için progresif bir nöropsikiyatrik bozukluk ve nöropatolojik doğrulama şarttır. Olası (probable) varyant Creutzfeldt-Jacob hastalığı tanısı için 6 aydan uzun süren progresif bir nöropsikiyatrik bozukluğun bulunması, başka etyolojik neden bulunmaması, iyatrojenik veya genetik olma olasılığının bulunmamasının yanı sıra erken psikiyatrik belirtiler, duysal belirtiler, ataksi, miyokloni-kore-distoni, demans bulgularından 4ünün bulunması, EEGnin tipik paroksizmleri göstermemesi ve MRda pulvinar hiperintensitesinin görülmesi gereklidir. Bunun yerine progresif bir nöropsikiyatrik bozukluk ile birlikte pozitif tonsil biyopsisi de kabul edilir.
Şekil 6. Difüzyon ağırlıklı MR incelemelerinde Creutzfeldt-Jacob Hastalığı için tipik bir bulgu olan kortikal kurdele görüntüsü (Kliniğimizin Demans ekibinin koleksiyonundan)
AIDS ve Nörolojik Komplikasyonları
Son yıllarda geliştirilen yeni ilaçlar ile insan immünyetmezlik virüsü (HIV) ile infekte olan hastaların yaşam süresi normal popülasyona oldukça yaklaşmıştır. Fakat nörolojik komplikasyonlar hala oldukça sık olarak gözlenmektedir. Nörolojik bulgular HIV ve fırsatçı infeksiyonlar nedeniyle gelişebileceği gibi, ilaçların yan etkisi olarak da ortaya çıkabilir. Edinsel immün yetersizlik sendromu (AIDS), seyrek görülen veya neredeyse ortadan kalkmış olan pek çok hastalığı tekrar gündeme getirmiştir. AIDS hastalarında görülebilecek nörolojik komplikasyonların bir listesi Tablo 13da verilmektedir.
Tablo 13. AIDS hastalarında görülebilen nörolojik komplikasyonlar
|
Tutulan bölge |
Fırsatçı infeksiyonlar |
Fırsatçı infeksiyonun tedavisi |
Fırsatçı infeksiyon dışı nedenler |
|
Beyin-yaygın |
Listeria CMV Toksoplazmoz
|
Ampisilin Gansiklovir, foskarnet Primetamin/sulfadiazin veya klindamisin |
-Metabolik -HIV ilişkili nörokognitif bozukluk |
|
Beyin-fokal |
Toksoplazmoz PML VZV Aspergilloz |
Yukarısı ile aynı Sitarabin, antiretroviral ajanlar Asiklovir veya famsiklovir Amfoterisin-B |
-Primer MSS lenfoması -IRIS |
|
Meninksler |
Kriptokok Sifiliz Tüberküloz
HSV I ve II |
Amfoterisin-B, flusitozin Penisilin INH + rifampisin + etambutol + pirazinamid Asiklovir |
-Lenfoma (primer veya metastatik) -HIV menenjiti |
|
Omurilik |
HSV I ve II VZV Sifiliz |
Asiklovir Asiklovir veya famsiklovir Penisilin |
-Vakuoler miyelopati -Lenfoma |
|
Kranial / periferik sinirler |
CMV VZV Listeria Mantar menenjti |
Gansiklovir, foskarnet Asiklovir veya famsiklovir Ampisilin Amfoterisin-B |
-HIV nöropatisi -CIDP -Toksik nöropati -Periferik yüz felci -AİDP benzeri nöropati |
|
Kas |
S.aureus miyoziti |
Uygun antibiyotik |
-HIV ilişkili miyopati -Zidovudin miyopatisi |
CMV: Sitomegalovirüs, PML: Progresif multifokal lökoensefalopati, VZV: Varicella zoster virüsü, HSV: Herpes zoster virüsü, HIV: İnsan immün yetmezlik virüsü, CIDP: Kronik inflamatuvar demiyelinizan polinöropati, AİDP: Akut inflamatuvar demiyelinizan poliradikülonöropati, IRIS: Immune reconstitution inflammatory syndrome.
HIV ilişkili nörokognitif bozukluk
HIV nedeniyle gelişen nörokognitif bozukluk asemptomatik kognitif etkilenmeden, HIV ilişkili demansa kadar çok farklı şiddette kendini gösterebilir. Özellikle yeni ilaç tedavilerinin ortaya çıkmasıyla HIV ilişkili demans oranı belirgin olarak azalmıştır. Ancak daha hafif seviyelerdeki kognitif bozukluk virüs ile infekte olan hastaların yaklaşık %50sinde izlenmektedir. Burada beynin HIV virüsü ile doğrudan infekte olması sonucunda ortaya çıkan HIV ilişkili demanstan söz edilecektir. HIV ilişkili demans, kortikal tipteki demanslarda bulunan afazi, aleksi, agrafi gibi özelliklerin bulunmadığı, davranış değişiklikleri ve bradikinezi ve koordinasyon bozukluğu gibi motor bozukluğun ön planda olduğu, subkortikal olarak adlandırılabilecek bir demans tablosudur. Genellikle başlangıcından sonra, 6 ay-1 yıl içinde ölümle sonlanan hızlı ilerleyici bir tablodur. HIV ilişkili nörokognitif bozukluk hastalığın hemen her evresinde izlenirken, HIV ilişkili demans tablosu sıklıkla CD4+ lenfosit sayısının azaldığı ileri evrede izlenir. Patolojik incelemede özellikle bazal ganglia bölgesinde perivasküler mononükleer infiltrasyon, frontal loblarda nöron kaybı, yaygın mikroglial aktivasyon ve ak maddede yaygın vakuolleşme görülür. Vakuoler miyelopati de eşlik edebilir. MRda yaygın atrofi ve periventriküler simetrik ve kontrast tutmayan hiperintens alanlar görülebilir. Anti-retroviral tedavi almayan hastalarda BOSta ılımlı mononükleer hücre artışı, protein artışı ve intratekal IgG sentezi görülebilir; HIV RNAsı saptanır. Anti-retroviral tedavi altındaki hastalarda BOS bulguları silikleşebilir. Tedavisinde en önemli nokta çok etkin AIDS tedavisinin yapılmasıdır. Önceden anti-retroviral almayan hastalarda bazen tedavinin başlanmasıyla birlikte paradoksal bir kötüleşme ortaya çıkabilir. İmmün rekonstitüsyon inflamatuvar sendromu (IRIS) adı verilen bu tablo radyolojik olarak AIDS hastalarında görülebilen progresif multifokal lökoensefalopatiye (PML) benzer geniş lökoensefalopati alanları ile karakterizedir, ancak JC virüs izole edilemez ve histopatolojik olarak yoğun sitotoksik T-lenfosit infiltrasyonu görülür. Bu tablonun tedavisinde steroidlerin yeri olabilir.
Yeni Tip Koronavirüs (COVID-19) İnfeksiyonu
Esasen bir solunum yolu virüsü olan koronavirüsün, 2019 yılının sonunda başlayarak tüm dünyayı etkisi altına alan COVID-19 (Coronavirus Disease 2019) pandemisi sırasında giderek artan sıklıkta nörolojik bulgular bildirilmektedir. Virüs, hücre içine girerken anjiyotensin dönüştürücü enzim-2 reseptörünü (ACE-2-R) kullanmaktadır. Bu reseptör MSSde de bulunduğundan, virüsün nörotropik bir karakteri olduğu düşünülmektedir. Nörolojik bulgulara retrograd transnöronal taşınma veya hematojen yolla ulaşarak neden olduğu öne sürülmektedir. Hastaların önemli bir kısmında başağrısı, dizziness, miyalji gibi nonspesifik semptomlar görülmektedir. Tat alma ve koku duyusunda kayıp hastalığın kimi zaman başlangıç bulgusu olabilmektedir. Bunlar haricinde, hastalığın seyrinde ortaya çıkan protrombotik eğilim ve endotel disfonksiyonu nedeniyle iskemik serebrovasküler hastalıklara neden olduğu gösterilmiştir. Ayrıca, epilepsi, Guillain-Barré sendromu, meningoensefalit, periferik fasiyal paralizi, trigeminal nevralji olguları da bildirilmektedir. Bu olguların daha önceki koronavirüs salgınlarında da izlenmesi, COVID-19 ile bağlantısı konusunda fikir verse de kesin ilişkisi açısından yorum yapabilmek için daha çok veriye ve çalışmaya ihtiyaç duyulmaktadır.
Diğer Nadir İnfeksiyonlar
Whipple hastalığı
Tropheryma whippelii olarak adlandırılmış bir bakteri tarafından oluşturulur. Genellikle gastrointestinal yakınmalara ve eklem yakınmalarına neden olur. Halsizlik, gece terlemeleri, ateş, diyare, kilo kaybı, poliartrit ve lenfadenopati ile karakterize bir sistemik hastalıktır. Olguların %10-40ında nörolojik tutulum da görülebilir; bu durum sessiz, kronik veya fulminan gidişli olabilir. Klinik olarak progresif demansiyel bir tablo şeklinde veya nöbetlerle, ataksi ile, miyoklonilerle, supranükleer oftalmoparezi ile kendini gösterebilir. Hastaların %20sinde hastalık için özgül olduğu düşünülen konverjans şeklinde ritmik göz hareketleri ve mastikatör kaslarda kasılma ile kendini gösteren okülomastikatuvar miyoritmi tablosu izlenir. Jejunal biyopside PAS pozitif inklüzyon içeren makrofajların gösterilmesi veya BOSta PCR ile etken bakteri genomunun gösterilmesi ile tanı konabilir. Tedavide penisilin veya tetrasiklin yarar sağlayabilir.
Toksoplazmoz
Önceleri ender rastlanan bir hastalık olan MSS toksoplazmozu, AIDS ve tedavi amaçlı immünsupresyonun yaygınlaşmasından sonra hızla artmıştır. AIDS hastalarında görülen yer kaplayıcı lezyonların en sık nedeni toksoplazmozdur. Zorunlu hücre içi paraziti olan Toxoplasma gondii bağışıklık sistemi sağlam olan kişilerde çoğu zaman asemptomatik veya ılımlı bir lenfoproliferatif hastalığa yol açar ve dokularda latent olarak yerleşir. Eğer akut infeksiyon sırasında gebelik söz konusu ise fetusta çok ciddi bir hastalık olan konjenital toksoplazmoz gelişir. Dokularda latent olarak yerleşme durumunda ise, daha sonra hücresel immünitenin bozulduğu bir durum ortaya çıktığında, bu doku kistleri açılır ve invazif trofozoitler dokuya yerleşir. Bu durum beyinde genellikle multipl kistik lezyonlar (apseler) şeklinde karşımıza çıkar ve fokal nörolojik bulgularla kendini gösterir. Bunun dışında difüz ensefalopati tablosuna ya da akut bir meningoensefalit tablosuna da yol açabildiği bilinmektedir. Bağışıklık sistemi sağlam olan hastalarda kanda Toksoplazma antikor titresinin hızla 4 kat artış göstermesi yakın tarihli bir infeksiyonu gösterir. IgM antikorları akut infeksiyondan sonra 9 aya kadar pozitif bulunabilir. Bağışıklık sistemi bozuk kişilerde ise antikor titreleri düşük bulunabilir veya negatif kalabilir. BOSta da antikorlar saptanabilir. BOSta mononükleer hücre artışı ve ılımlı protein artışı görülür, şeker hafifçe azalmış olabilir. Nöroradyolojik yöntemler arasında MR, BTden daha duyarlıdır: tek veya multipl çevresel kontrast tutulumu gösteren yer kaplayıcı lezyon/lar görülür. Bu lezyonlardan alınan doku örneğinde trofozoitlerin gösterilmesi ile kesin tanıya varılır. Genellikle latent bir infeksiyonun reaktivasyonu söz konusu olduğundan antikorların tanıda yeri yoktur. Sadece intratekal antikor üretimi gösterilebilirse MSS toksoplazmozu tanısını destekleyebilir. AIDSli veya diğer nedenlere bağlı hücresel immünitesi bozulmuş hastalarda MSS toksoplazmozu ayırıcı tanısında MSS lenfoması, tüberkülomlar, mantar apseleri yer alır. Bu durumda invazif tanı girişiminden önce ampirik olarak toksoplazmoz tedavi denemesi önerilmektedir. MSS toksoplazmozu tedavisinde ilk tercih primetamin/sulfadiazindir. Bunun haricinde trimetoprim-sulfametoksazol, klindamisin, atovoquane kullanılmaktadır.
Nörosistiserkoz
Sistiserkoz etkeni olan Tenia solium domuz eti ile bulaştığı için, bu hastalık ülkemizde ender görülür. Az pişmiş domuz etinin yenmesi ile etin içindeki kistlerdeki larva basakta yerleşir. Tenya oluştuğunda yumurtaları barsak boşluğundan venöz sistem yolu ile dokulara yayılır ve kistlere yol açar. Beyin de kistlerin tercih ettiği organlardan biridir. Kistler çok yavaş büyür, larvanın ölmesi ile bir inflamatuvar reaksiyon gelişir ve kist kalsifiye olur. Klinik tablo sıklıkla nöbetlerle karakterizedir. Bazen obstrüktif hidrosefali gelişebilir, seyrek olarak ani inme-benzeri tablolar görülebilir. BOS normal olabileceği gibi, lenfositik hücre artışı, ılımlı protein artışı, şeker azalması saptanabilir. BTde çok az kontrast tutan kalsifiye lezyonların görülmesi tanıda yardımcı olur. Çocuklarda daha akut ve daha fazla kontrast tutan lezyonlar görülebilir. Gaita incelemesinin sadece çocuklarda tanıya yardımcı rolü vardır. Tedavide albendazol veya albendazol/prazikuantel kombinasyonu kullanılır.
Progresif multifokal lökoensefalopati
JC (John Cunningham) virüs adı verilen bir polioma virüsünün etkeni olduğu PML, hücresel bağışıklığın bozulduğu durumlarda ortaya çıkar. Virüs tarafından infekte olan oligodendrositlerin ölümüne yol açar ve hem subkortikal ak maddede hem de kortekste tutulum gösterir. Özellikle AIDS hastalarında ve organ transplantasyonu veya otoimmün hastalık nedeniyle immünsupresif tedavi alan hastalarda görülür. MS tedavisinde kullanılan, alfa-4 integrine karşı monoklonal antikor natalizumab tedavisi alan hastalar başta olmak üzere, rituksimab, mikofenolat mofetil, ekulizumab, ofatumumab gibi ilaçlar ile gözlenmesi sonucunda PML tekrar önem kazanmıştır. Klinik olarak davranış değişikliklerinin eşlik ettiği yavaş progresif demansiyel bir tablo şeklinde karşımıza çıkar; görme alanı defektleri de görülebilir. Fokal nörolojik bulgular da izlenebilir. MRda multifokal, geniş, kontrast tutmayan ak madde hiperintensiteleri görülür. Nedeni bilinmemekle birlikte, PMLde optik sinir ve omurilik tutulumu görülmez. BOS incelemesi normal olabileceği gibi, ılımlı pleositoz ve ılımlı protein artışı görülebilir. PCR ile JC virüs DNAsının saptanması tanı koydurucudur. PCRla tanı konamayan hastalarda biyopsi yararlı olabilir. Natalizumab kullanan hastalarda ilacın kesilmesi veya HIV hastalarında, antiretroviral tedavinin başlanması ile IRIS tablosu ortaya çıkabilir.
Şarbon menenjiti
İnsanlarda nadir görülen bu zoonotik hastalık, 2001 yılında Amerika Birleşik Devletlerinde biyoterörizm şüphesi ile gündeme gelmiştir. Ciltte, gastrointestinal sistemde veya akciğerlerde hastalık bulguları vardır. Olguların yaklaşık %5inde şarbon menenjiti görülebilir. Çok hızlı progresyon gösteren akut menenjit kliniği ile karakterizedir ve saatler içinde ölümle sonlanabilir. BT ve MRda da kanama odakları görülebilir. BOSta polimorf hakimiyetli pleositoz yanında kan da bulunur ve yanlışlıkla subaraknoid kanama olarak değerlendirilebilir. Genellikle protein artmış, şeker azalmış bulunur; Gram negatif çomaklar görülebilir. Çok hızlı ilerleyerek fatal sonlanabildiği için kinolonların yanı sıra iki antibiyotiğin (ampisilin, meropenem, rifampisin, vankomisin gibi) daha kullanıldığı üçlü bir rejim önerilmektedir.
Bakteri Toksinleri ile Ortaya Çıkan Nörolojik Tablolar
Tetanoz
Zorunlu anaerob bir çomak olan Clostridium tetani, vücuda açık yaralar yolu ile girer. Yaranın büyük veya küçük olmasının bir önemi yoktur. Küçük bir çizik ile deri bütünlüğünün bozulması bile ortamda bakteri varsa tetanoza yol açabilir. Ancak yanıklar, açık ve multipl kırıklar, steril koşullar uygulanmadan gerçekleştirilen ameliyatlar, umbilikal kord kesileri ve abortuslar özellikle risk taşır. Dört klinik şekilde karşımıza çıkabilir: neonatal, jeneralize, lokalize veya sefalik formları vardır. Tetanoz bulguları ortaya çıkmadan önce birkaç günden birkaç haftaya değişebilen bir inkübasyon dönemi vardır. Neonatal tetanoz yaşamın ikinci haftasında genel bir güçsüzlük ve emme zorluğu ile başlar, daha sonra tetanik spazmlar ve rijidite gelişir. Lokalize tetanoz genellikle yara bölgesine yakın bir bölgeye sınırlı kasılmalar ve refleks canlılığı ile karakterizedir ve zamanla ya jeneralize hale dönüşür ya da spontan olarak düzelir. Sefalik form da bulguların baş ve yüz kaslarına sınırlı olduğu bir tür lokalize tetanoz formudur ve genellikle kötü prognozlu olduğu kabul edilir. Jeneralize tetanoz ise en sık karşılaşılan formdur. Masseter kaslarının kasılmasıyla trismus (çene kilitlenmesi) görülür. Abdominal kasların tonusu artar ve zaman zaman ani tetanik spazmlarla vücut opistotonus postürü alır. Bu spazmlar sırasında kollar fleksiyona gelir, yumruklar sıkılır, boyun, gövde ve alt ekstremite ekstansiyona gelir. Bu sırada bilinç kaybı olmaz, ancak bu spazmlar çok ağrılıdır. Ayrıca solunum yolunun kapanması riski vardır. Bulguların ortaya çıkmasından sonra tablo 10-14 gün boyunca ilerlemeye devam edebilir. Tabloya ateş, hipertansiyon, taşikardi, bazen bradikardi ve aşırı terleme gibi otonom sinir sistemi bulguları eşlik edebilir.
Bu tablodan Clostridium tetaninin tetanospazmin adı verilen, tetanoz toksini olarak da bilinen toksini sorumludur. Yara bölgesindeki Clostridium tetanilerin ürettiği tetanospazmin, nöromüsküler bileşkede pre-sinaptik membrana bağlanarak hücre içine girer ve retrograd transport ile motor nöron boyunca ilerleyerek omurilikteki ve beyinsapındaki presinaptik glisinerjik ve GABA-erjik inhibitör hücrelere ulaşır; bunlardan glisin ve GABA salınımını engeller. Bunun sonucunda hem motor nöronun istirahat aktivitesini arttırır, hem de bazı kasların hareketi için gerekli olan antagonist kasların normal inhibisyonunu ortadan kaldırarak şiddetli kasılmalara yol açar ki, bu durum karşımıza tetanik spazmlar olarak çıkar. Bunun dışında omurilikteki sempatik reflekslerin de inhibisyonunu ortadan kaldırır. Tetanospazminin üçüncü etkisi de yara bölgesi çevresinde nöromüsküler bileşke blokaji yapmasıdır.
Tetanoz tanısı klinik bulgulara dayanılarak konur. EMG tanıda yol gösterici olabilir. Başka bir tanı koydurucu laboratuvar bulgusu yoktur. Ancak diğer olasılıkların dışlanması için laboratuvar incelemeleri gerekli olabilir. Tetanoz ayırıcı tanısına giren durumlar arasında striknin intoksikasyonu (striknin sadece glisinerjik nöronları inhibe eder), ilaçlara bağlı akut distonik reaksiyonlar, nöroleptik malign sendrom, nadiren menenjite bağlı ense sertliği, hipokalsemiye bağlı tetani, otoimmün veya paraneoplastik bir hastalık olan stiff person sendromu yer alabilir.
Tedavi
Tetanoz tedavisinde uygun reanimasyon koşullarında hava yolu kontrolü ve destek tedavisinin önemi çok büyüktür. Bu sayede tetanoz mortalitesi önemli ölçüde azalmıştır. Bunun yanı sıra tanı koyulur koyulmaz 3000-6000 ünite insan tetanoz immünglobulini verilmelidir. İnsan immünglobulini yoksa at serumu verilebilir. Tetanoz aşısı uygulanırsa tekrarları önlemesi açısından yararlı olabilir. Eğer yara yerinde infeksiyon varsa ve cerrahi olarak temizlenmesi gerekiyorsa bu yapılmalıdır ve yara bölgesi de insan tetanoz immünglobulini ile infiltre edilmelidir. Aynı zamanda 10 günlük penisilin veya tetrasiklin tedavisi verilmelidir. Destek tedavisi içinde kasılmaları önleyici önlemler de yer alır. En çok tercih edilen ajanlar yüksek doz benzodiyazepinlerdir. Ancak kesilirken tepki reaksiyonuna yol açmamak için doz yavaşça azaltılmalıdır. Baklofen veya dantrolen de kullanılabilir. Eğer bunlarla kasılmalar önlenemezse kürar ile nöromüsküler blokaj gerekli olabilir. Hepsinden önemlisi, aktif immünizasyonla tetanozun önlenmesidir.
Difteri
Çocukluk dönemindeki yaygın aşılama sonucu nadir bir hastalık haline gelen difterinin etkeni Corynebacterium diphteriaenin endotoksini olguların yaklaşık %5inde nörolojik bulgulara yol açabilir. Bakteri boğazda yerleşir ve endotoksin üretmeye başlar. Bunun ardından 5-10. günler arasında yumuşak damak felci gelişir. Ardından diğer kranial sinir felçleri ortaya çıkar. Ekstraoküler kaslar nadiren tutulur, ancak akomodasyon refleksi bozulur. Bazen bu tablonun ardından birkaç hafta içinde asendan simetrik sensori-motor bir polinöropati gelişebilir. Progresyon 1-2 hafta sürdükten sonra hasta yavaş yavaş düzelmeye başlar. Bu tablodan endotoksinin periferik sinir proksimal bölümlerinde ve spinal köklerde yol açtığı demiyelinizasyon sorumludur. Tedavide difteri semptomları başlar başlamaz antitoksin verilmesi önerilir, ancak nörolojik komplikasyonların destek tedavisi dışında tedavisi yoktur.
Botulizm
(Ayrıca bakınız: Kas ve Nöromüsküler Kavşak Hastalıkları) Seyrek görülen ancak öldürücü bir hastalık olan botulizm, başlıca üç şekilde görülür: besinlerle ilgili botulizm, yara botulizmi ve bebeklerde görülen botulizm. Etkeni anaerob bir bakteri olan Clostridium botulinumun bugüne dek belirlenmiş 8 toksininden biridir. En sık A, B, E ve nadiren de F, G ve H toksinleri ile hastalık görülmektedir. Bunlardan E toksinini üreten bakteri sporları 800 C sıcaklıkta 10 dakika ısıtma ile inaktive olurken, diğerleri 2 saat kaynatmaya bile dirençli olabilirler.
Besinlere bağlı botulizm sıklıkla evde hazırlanmış konserveler, uygun olmayan koşullarda hazırlanan ve saklanan balık ve et ürünleri ile ilişkilidir. Aynı yiyeceği yiyen birçok kişide birden hastalık belirtileri ortaya çıkar. Yara botulizmi ise açık fraktürlerin olduğu geniş ve toprakla kirlenmiş yaralanmalardan sonra görülür. Bebek botulizmi ise hayatın ilk 9 ayında, sıklıkla 2-3. aylarında gelişir. Bal yedirme ile ilişkili olabileceği bildirilmiş, ancak emzirme veya biberonla besleme gibi diğer faktörlerle net bir ilişkisi gösterilememiştir. Gerek yara yoluyla gerekse gastrointestinal yolla alınan Clostridium botulinum bakterileri burada çoğalırlar ve toksin üretirler. Toksin lenfatik yolla taşınır ve üç ayrı noktaya bağlanır: 1. nöromüsküler bileşkede presinaptik uca; 2. post-gangliyonik parasempatik sinir uçlarına; 3. otonom gangliaya bağlanır ve asetilkolin salınımını geri dönüşsüz olarak bloke eder. İyileşme ancak yeni nöromüsküler bileşke oluşumu ile gerçekleşir.
Klinik tablo: Besinlere bağlı botulizmin başlangıcında akut bir gastroenterit benzeri tablo görülür. Bozuk besinin alınmasından 6 saat-1 hafta sonra bulantı-kusma ve ishal görülür. Ardından tipik olarak ekstraoküler kas zaafı ve diğer kranial sinir felçleri ile ağız kuruluğu ve kabızlık gibi otonom bozukluklar ortaya çıkar. Ağır olgularda ekstremitelerde gevşek felç ve solunum felci gelişebilir. Refleksler normal veya hipoaktif bulunabilir. Bulgular aylar içinde gerileyebilir.
Tanı için öykü ve klinik bulguların yanı sıra EMG çok yararlıdır. Baştan düşük olan kas aksiyon potansiyeli amplitüdünün kısa süreli maksimal kası ya da yüksek frekanslı repetitif stimülasyonla dramatik artış göstermesi tipiktir. Ayrıca EMG ile ayırıcı tanıda yer alabilecek miyastenia gravis ve akut inflamatuvar demiyelinizan nöropati olasılıkları da dışlanmış olur. Gaita veya yara materyali kültüründe Clostridium botulinum üretilebilir. BOS normaldir. Tanıda yardımcı olabilen başka bir laboratuvar yöntemi de yoktur.
Tedavi: Botulizm hastalarında hangi toksinin sorumlu olduğu klinik olarak ayırt edilemediğinden, tanı koyulur koyulmaz heptavalan antiserum verilmelidir. Antiserumun ne kadar erken verilirse o kadar yararlı olacağı unutulmamalıdır. Ancak, anafilaktik reaksiyonlar yapabileceği de akılda tutulmalıdır. Ayrıca gastrointestinal kanalın magnezyum içermeyen katartiklerle temizlenmesi gerekir. Yara botulizminde yara temizliği yapılmalı ve antibiyotik tedavisi uygulanmalıdır (yüksek doz penisilin). Yoğun destek tedavisi sağlanması tedavinin en önemli kısmıdır. Hastanın aylarca reanimasyon koşullarında izlenmesi gerekli olabilir. Bunların dışında guanidinin yararlı olabileceği düşünülmektedir.
Kaynaklar
1. Ropper AH, Samuels MH, Klein JP, Prasad S (editörler). Adams and Victors Principles of Neurology, 11. baskı. Mc Graw Hill, New York, 2019.
2. Aminoff M (editör). Neurology and General Medicine. Churchill Livingstone Elsevier, 2008.
3. Scheld WM, Whitley RJ, Marra CM (editörler). Infections of the Central Nervous System, 3.baskı. Lippincott Williams & Wilkins, Philadelphia, 2004.
4. van de Beek D, de Gans J, Spanjaard L, ve ark. Clinical features and prognostic factors in adults with bacterial meningitis. N Engl J Med 2004; 351: 1849-1859.
5. Roche M, Humphreys H, Smyth E, ve ark. A twelve-year review of central nervous
system bacterial abscesses; presentation and etilology. Clin Microbiol Infect 2003; 9:
803-809.
6. Rzaska M, Niewiadomski S, Karwacki Z. Molecular mechanisms of bacterial
infections of the central nervous system. Anaesthesiol Intensive Ther 2017;49(5):387‐392.
7. Davis LE. Acute Bacterial Meningitis. Continuum (Minneap Minn). 2018;24 (5,
Neuroinfectious Disease):1264‐1283.
8. Brouwer MC, McIntyre P, Prasad K, van de Beek D. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev 2015;(9):CD004405.
9. Halperin JJ. Neuroborreliosis and Neurosyphilis. Continuum (Minneap Minn). 2018;24(5,NeuroinfectiousDisease):1439‐1458.
10. World Health Organization. Guidelines for treatment of drug-susceptible tuberculosis and patient care. who.int/tb/publications/2017/ dstb_guidance_2017/en/. Published April 2017. Accessed July 26, 2018.
11. Prasad K, Singh MB, Ryan H. Corticosteroids for managing tuberculous meningitis. Cochrane Database Syst Rev 2016;4:CD002244
12. Zunt JR. Tuberculosis of the Central Nervous System. Continuum (Minneap Minn). 2018;24(5, Neuroinfectious Disease):1422‐1438.
13. Jessen NA, Munk AS, Lundgaard I, Nedergaard M. The Glymphatic System: A
Beginner's Guide. Neurochem Res. 2015 Dec;40(12):2583-99.
14. Plog BA, Nedergaard M. The Glymphatic System in Central Nervous System
Health and Disease: Past, Present, and Future. Annu Rev Pathol. 2018 Jan 24;13:379-
394.
15. Sejvar JJ. Clinical manifestations and outcomes of West Nile virus infection. Viruses 2014; 6:606.
16. Carteaux G, Maquart M, Bedet A, ve ark. Zika Virus Associated with Meningoencephalitis. N Engl J Med 2016;374:1595-1596.
17. Dalmau J, Gleichman AJ, Hughes EG, ve ark. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurol 2008;7:1091-1098.
18. Ihekwaba UK, Kudesia G, McKendrick MW. Clinical features of viral meningitis in adults: significant differences in cerebrospinal fluid findings among herpes simplex virus, varicella zoster virus, and enterovirus infections. Clin Infect Dis 2008;47:783-789.
19. Green AJE, Zanusso G. Prion protein amplification techniques. Handbook of Clinical Neurology 2018;153:357-370.
20. Le LT, Spudich SS. HIV-Associated Neurologic Disorders and Central Nervous System Opportunistic Infections in HIV. Semin Neurol 2016;36:373-381.
21. Bally JF, Meneret A, Roze E, ve ark. Systematic review of movement disorders and oculomotor abnormalities in Whipple's disease. Mov Disord 2018;33:1700-1711.
22. Garcia HH, Gonzales I, Lescano AG, ve ark. Efficacy of combined antiparasitic therapy with praziquantel and albendazole for neurocysticercosis: a double-blind, randomised controlled trial. Lancet Infect Dis 2014;14:687-695.
23. Tan IL, McArthur JC, Clifford DB, ve ark. Immune reconstitution inflammatory syndrome in natalizumab-associated PML. Neurology 2011;77:1061-1067.
24. Gomez-Cibeira E, Ivanovic-Barbeito Y, Gutierrez-Martinez E, ve ark. Eculizumab-related progressive multifocal leukoencephalopathy. Neurology 2016;86:399-400.
25. Carson KR, Evens AM, Richey EA, ve ark. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood 2009;113:4834-4840.
26. Neff RT, Hurst FP, Falta EM, ve ark. Progressive multifocal leukoencephalopathy and use of mycophenolate mofetil after kidney transplantation. Transplantation 2008;86:1474-1478.
27. Centers for Disease C, Prevention. Investigational heptavalent botulinum antitoxin (HBAT) to replace licensed botulinum antitoxin AB and investigational botulinum antitoxin E. MMWR Morb Mortal Wkly Rep 2010;59:299.
Teşekkür
Şekillerdeki katkılarından dolayı Dr. A Emre Ögeye, Dr Can Baykala, Dr Haşmet Hanağasına ve tablolardaki katkılarından dolayı Dr. Yakup Krespiye teşekkürlerimizi sunarız.